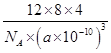(1)SiO4-是构成硅酸盐的基本结构单元,通过共用氧相连可形成硅氧组群。
①基态硅原子价电子排布图是____________________。
②写出与SiO4-具有相同空间构型和键合形式的微粒,分子和离子各写一个_______。
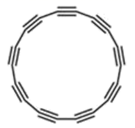
③下图为一种硅氧组群的结构示意图,其离子符号为____,其中Si原子的杂化方式为_____。

④电负性:Si____O(填“>”、“=”或“<”) 。
(2)2017年,我国科学家又在碳原子研究上获得突破:由中科院大学物理学院苏刚教授等人通过理论计算预言的一种三维碳结构T-碳(T-carbon) 诞生,中外科学家联合研究团队成功合成了T-碳,从而使T-碳成为可与石墨和金刚石比肩的碳的另一种三维新结构。T碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如下图。T-碳属于_____晶体。已知T-碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T碳的密度的表达式为_______g/cm3。(写出表达式即可)

答案
![]() CCl4和 PO43-、SO42-.、ClO4-、(其它合理答案也给分) Si6O1812- sp3 < 原子 ρ=
CCl4和 PO43-、SO42-.、ClO4-、(其它合理答案也给分) Si6O1812- sp3 < 原子 ρ=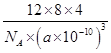
【解析】
(1)①硅为14号元素,基态硅原子价电子排布图是![]() ,故答案为
,故答案为![]() ;
;
②与SiO4-具有相同空间构型和键合形式的微粒有:CCl4和 PO43-、SO42-.、ClO4-,故正确答案为:CCl4和 PO43-、SO42-.、ClO4-(PO43-、SO42-.、ClO4-任填一个)
③根据硅氧组群的结构示意图,结构中含有6个硅氧四面体,其离子符号为Si6O1812-,其中Si原子与周围4个O原子相连,采用sp3杂化,故答案为Si6O1812- ; sp3 ;
④氧元素的电负性大于碳,而碳元素的电负性大于硅,因此电负性:Si<O,故答案为<。
由信息:T碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,故T-碳属于原子晶体。
根据原子均摊法可计算出T碳晶胞中含有的碳原子结构单元个数为:8×![]() +6×
+6×![]() +4=8,则
+4=8,则
ρ=m/V=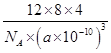 g/cm3,因此,本题正确答案为:ρ=
g/cm3,因此,本题正确答案为:ρ=