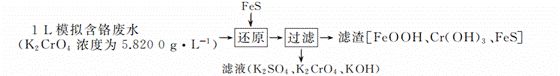
三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]是制备负载型活性铁催化剂的主要原料。某化学小组探究用废铁屑(含少量-2价S元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体。具体流程如图:

已知:①(NH4)2Fe(SO4)2•6H2O为蓝绿色晶体,FeC2O4·2H2O为难溶于水的黄色晶体,K3Fe(C2O4)3·3H2O为可溶于水、难溶于乙醇的翠绿色晶体。
②25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O
[Fe(SCN)]2+(aq)+3C2O![]() (aq) K=6.31×10-17。
(aq) K=6.31×10-17。
③[Fe(SCN)]2+(aq)为血红色。
回答下列问题:
(1)三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]中铁的化合价是_____。
(2)废铁屑中加入10%NaOH并加热的目的是__。
(3)为防止污染空气,反应所产生的“废气”可选择__净化处理。(填选项)
A.H2O B.NaOH溶液 C.盐酸 D.CuSO4溶液
(4)写出浅绿色悬浊液中加入饱和H2C2O4生成黄色沉淀的化学方程式:__。
(5)制备过程中加入6%H2O2的目的是__,温度保持70~80℃,采用的合适加热方式是__。
(6)获得翠绿晶体的操作①是___。
(7)用乙醇洗涤晶体的原因是___。
(8)某同学欲检验所制晶体中的Fe(Ⅲ),取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴0.1mol•L-1KSCN溶液。请判断上述实验方案是否可行并说明理由:___。
答案
+3 去除废铁屑表面的油污 BD (NH4)2Fe(SO4)2•6H2O+H2C2O4=FeC2O4•2H2O+(NH4)2SO4+H2SO4+4H2O 将Fe(Ⅱ)氧化成Fe(Ⅲ) 水浴加热 加热浓缩,冷却结晶,过滤 为了除去晶体表面残留的水分且防止晶体溶解损失 否,因为[Fe(C2O4)3]3-转化为[Fe(SCN)]2+反应的平衡常数小于1.0×10-5,观察不到明显现象,所以无法检验
【分析】
废铁屑先用热的NaOH溶液除去表面的油污,然后加入稀硫酸,铁和稀硫酸反应生成硫酸亚铁,-2价S元素遇酸转变为有毒气体H2S,H2S可以用NaOH溶液或CuSO4溶液吸收。得到的硫酸亚铁溶液中加入氨水,生成(NH4)2Fe(SO4)2•6H2O,再加入饱和H2C2O4,生成难溶于水的黄色晶体FeC2O4·2H2O,过滤后向沉淀中加入饱和K2C2O4,然后加入6%H2O2溶液,使Fe(Ⅱ)被氧化成Fe(Ⅲ),再加入饱和H2C2O4,得到K3Fe(C2O4)3溶液,溶液经蒸发浓缩、冷却结晶,过滤得到K3Fe(C2O4)3·3H2O晶体,用乙醇洗涤,干燥后得到纯净的K3Fe(C2O4)3·3H2O。
【详解】
(1)三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]中钾为+1价,碳为+3价,氧为-2价,根据正负化合价代数和为0的原则,可计算出铁的化合价是+3价。
(2)废铁屑长期露置于空气中,表面会有油污,加热时油污可以在碱性环境下彻底水解,所以加入10%NaOH并加热的目的是去除废铁屑表面的油污。
(3)废铁屑中-2价S元素遇酸转变为有毒气体H2S,H2S是酸性气体,能溶于碱溶液,可以用NaOH溶液吸收,H2S也可以和硫酸铜溶液反应生成CuS沉淀,所以也可以用CuSO4溶液吸收,故选BD。
(4)浅绿色悬浊液中有(NH4)2Fe(SO4)2•6H2O,加入饱和H2C2O4生成黄色沉淀FeC2O4·2H2O,化学方程式为:(NH4)2Fe(SO4)2•6H2O+H2C2O4=FeC2O4•2H2O+(NH4)2SO4+H2SO4+4H2O。
(5)黄色沉淀是FeC2O4·2H2O,其中铁是+2价,要制备的K3Fe(C2O4)3•3H2O中铁是+3价,所以需要将Fe(Ⅱ)氧化成Fe(Ⅲ),所以加入6%H2O2的目的是将Fe(Ⅱ)氧化成Fe(Ⅲ),温度保持70~80℃,采用的合适加热方式是水浴加热。
(6)从K3Fe(C2O4)3溶液中获得K3Fe(C2O4)3·3H2O晶体,需经蒸发浓缩、冷却结晶,过滤。
(7)由于K3Fe(C2O4)3·3H2O难溶于乙醇,所以用乙醇洗涤,既可以除去晶体表面残留的水分,又能防止晶体溶解损失。
(8)根据[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O42- (aq) K=6.31×10-17,因为[Fe(C2O4)3]3-转化为[Fe(SCN)]2+反应的平衡常数小于1.0×10-5,观察不到明显现象,所以无法检验所制晶体中是否含Fe(Ⅲ)。
[Fe(SCN)]2+(aq)+3C2O42- (aq) K=6.31×10-17,因为[Fe(C2O4)3]3-转化为[Fe(SCN)]2+反应的平衡常数小于1.0×10-5,观察不到明显现象,所以无法检验所制晶体中是否含Fe(Ⅲ)。
【点睛】
从溶液中获得晶体的方法有蒸发结晶和冷却结晶。对于溶解度受温度影响不大的物质,如NaCl,就可以通过蒸发结晶的方法获得晶体,对于溶解度受温度影响较大的物质如KNO3,需要通过冷却热饱和溶液的方法获得晶体。如果从溶液中获得带结晶水的晶体如CuSO4•5H2O等,也需要通过蒸发浓缩、冷却结晶的方法获得晶体,如果直接加热蒸发,结晶水容易失去。