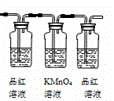
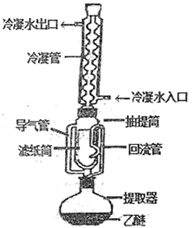
化学小组为探究SO2在酸性KI溶液中的反应,利用如图装置进行实验:

I.排出装置内的空气。减缓CO2的流速,向丁装置中通入CO2和SO2的混合气体。
II.一段时间后,溶液变黄并出现浑浊,摇动锥形瓶、静置,苯与溶液边缘呈紫红色。
III.持续向丁装置中通入CO2和SO2混合气体,溶液变为无色。
IV.再静置一段时间,取锥形瓶中水溶液,滴加BeCl2溶液,产生白色沉淀。
回答下列问题:
(1)苯的作用为____________________________。排出装置内空气的具体操作为_________________________________。
(2)步骤II反应的离子方程式为____________________________________。步骤III反应的离子方程式为_______________________________________。
(3)实验的总反应的化学方程式为_________________________________________,
KI和HI在反应中的作用为______________________________________________。
答案
萃取碘单质,隔绝空气防止I- 被氧化 关闭 K2,打开K3,打开K1(或打开K3关闭K2,打开K1) SO2+4I-+4H+=2I2+S↓ +2H2O SO2+I2+2H2O=4H++![]() +2I- 3SO2 +2H2O= 2H2SO4+S↓ 催化剂
+2I- 3SO2 +2H2O= 2H2SO4+S↓ 催化剂
【分析】
II.一段时间后,溶液变黄并出现浑浊,说明KI和二氧化硫反应有S单质生成,摇动锥形瓶、静置,苯与溶液边缘呈紫红色,说明有碘单质生成。III.持续向丁装置中通入CO2和SO2混合气体,溶液变为无色,说明SO2和碘单质发生了反应。
【详解】
(1) 苯能隔绝空气防止I- 被氧化,苯能萃取溶液中生成的碘单质;关闭 K2,打开K3、K1通入二氧化碳排出装置内空气;
(2)步骤II,溶液变黄并出现浑浊,说明KI和二氧化硫反应有S单质生成;摇动锥形瓶、静置,苯与溶液边缘呈紫红色,说明有碘单质生成,反应的离子方程式为SO2+4I-+4H+=2I2+S↓ +2H2O;
步骤III,持续向丁装置中通入CO2和SO2混合气体,溶液变为无色,说明SO2和碘单质发生了反应,反应的离子方程式为SO2+I2+2H2O=4H++![]() +2I-;
+2I-;
(3) 根据SO2+4I-+4H+=2I2+S↓ +2H2O、SO2+I2+2H2O=4H++![]() +2I-,可知碘单质是中间产物,实验的总反应的化学方程式为3SO2 +2H2O= 2H2SO4+S↓,反应SO2+4I-+4H+=2I2+S↓ +2H2O消耗碘离子、SO2+I2+2H2O=4H++
+2I-,可知碘单质是中间产物,实验的总反应的化学方程式为3SO2 +2H2O= 2H2SO4+S↓,反应SO2+4I-+4H+=2I2+S↓ +2H2O消耗碘离子、SO2+I2+2H2O=4H++![]() +2I-又生成碘离子,所以KI和HI在反应中的作用为催化剂;
+2I-又生成碘离子,所以KI和HI在反应中的作用为催化剂;