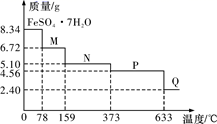
铁矿石主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有一种测定铁矿石中含铁量的方法如下。已知:2Na2S2O3+I2→Na2S4O6+2NaI。完成下列填空:

(1)步骤②用到的玻璃仪器除烧杯外,还有______。
(2)步骤③对应反应的离子方程式为______。
(3)步骤④中煮沸的作用是______。步骤⑤中必须用到的定量实验仪器是______。
(4)步骤⑦可用淀粉作为滴定终点的指示剂,达到滴定终点时的现象是______。若滴定过程中有空气进入,则测定结果______(选填“偏高”、“偏低”或“无影响”。
(5)若过程⑦中消耗0.5000mol/LNa2S2O3溶液20.00mL,则铁矿石中铁的百分含量为______。
答案
漏斗、玻璃棒 2Fe2++Cl2=2Fe3++2Cl- 除去过量的氯气,避免影响后续滴定 250mL容量瓶 溶液由蓝色恰好变为无色且30秒内不还原 偏高 70%
【详解】
(1)步骤②操作方法是过滤,用到的玻璃仪器时烧杯、玻璃棒、(普通)漏斗;
(2)铁矿石中含有铁的氧化物,杂质不含铁元素和氧元素,加入稀硫酸,铁的氧化物与稀硫酸发生反应,滤液A中有含铁元素的离子,通入足量氯气的目的是把溶液中Fe2+氧化成Fe3+,即离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(3)步骤③中通入过量的氯气,过量的氯气能与Na2S2O3发生反应,因此加热煮沸的目的是除去过量的氯气,避免对后续实验产生干扰;步骤⑤稀释至250mL溶液,这需要在容量瓶中进行操作,即步骤⑤必须用到的定量实验仪器是250mL容量瓶;
(4)加入足量的KI溶液,发生2Fe3++2I-=2Fe2++I2,向此溶液中滴加淀粉溶液,溶液变蓝,然后滴加Na2S2O3溶液消耗I2,因此滴定终点的现象是溶液由蓝色恰好变为无色且30秒内不还原;空气中氧气能把I-氧化成I2,使消耗的Na2S2O3的量增加,即所测结果偏高;
(5)根据反应的方程式可知2Fe3+~2I-~2Na2S2O3,矿石中铁元素的百分含量=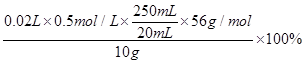 =70%。
=70%。
【点睛】
本题是一道探究物质的组成、测量物质的含量知识的一道综合考查题,考查学生分析和解决问题的能力,综合性强,难度大。本题的难点是样品中铁元素百分含量的确定,本题中不要根据所列反应方程式一一进行计算,应该用关系式进行计算,这样可以缩短解题的步骤,还要注意消耗20.00mLNa2S2O3溶液,应是20.00mLB溶液消耗的Na2S2O3,需要转化成250mLB溶液中消耗的Na2S2O3的量。



 N2+3Cu+3H2O
N2+3Cu+3H2O