全氮类物质具有高密度、高生成焓、超高能量及爆轰产物清洁无污染等优点,成为新一代超高能含能材料的典型代表。
Ⅰ.高性能炸药![]() 的结构为
的结构为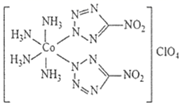 。
。
(1)![]() 基态原子的核外电子排布式为_______;O基态原子核外电子占据最高能级的电子云轮廓图形状为_______(用文字描述,下同);
基态原子的核外电子排布式为_______;O基态原子核外电子占据最高能级的电子云轮廓图形状为_______(用文字描述,下同);![]() 的空间构型为_______。
的空间构型为_______。
(2)写出与![]() 互为等电子体的阳离子的化学式_______;
互为等电子体的阳离子的化学式_______;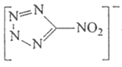 中所含各元素第一电离能由大到小的顺序为_______(用元素符号表示)。
中所含各元素第一电离能由大到小的顺序为_______(用元素符号表示)。
Ⅱ.作为新型高能含能材料,![]() 在炸药、推进剂和发射药等领域具有较高的应用价值。
在炸药、推进剂和发射药等领域具有较高的应用价值。
(3)![]() 为平面结构,结构为
为平面结构,结构为 ,其中N原子的杂化方式是_______。
,其中N原子的杂化方式是_______。
(4)![]() 的晶体结构与
的晶体结构与![]() 相似。
相似。![]() 的结构分为
的结构分为![]() 和
和![]() ,
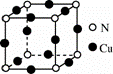
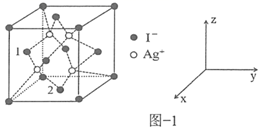
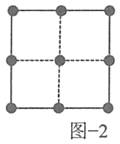
,![]() 立方晶胞的示意图见图-1。图-2是晶胞正上方的俯视投影图,图中黑球(实心球)表示
立方晶胞的示意图见图-1。图-2是晶胞正上方的俯视投影图,图中黑球(实心球)表示![]() ,请在题图-2中用白球(空心球)表示出
,请在题图-2中用白球(空心球)表示出![]() 的位置_______。
的位置_______。
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图-1中,原子1的坐标是(![]() ,0,
,0,![]() ),则原子2的坐标为_______。
),则原子2的坐标为_______。
答案
3d74s2 纺锤形 正四面体 H3O+ N>O>C sp2 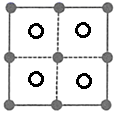 (
(![]() ,
,![]() ,0)
,0)
【解析】
(1)Co为27号元素,根据核外电子排布的规律书写基态Co原子电子排布式,再书写价层电子排布式;O为8号元素,基态O原子核外电子占据最高能级的电子为2p电子;根据价层电子对个数=σ键个数+孤电子对个数,孤电子对个数=![]() (a-xb)计算ClO4-的中心原子Cl的价层电子对数,再判断其空间构型;
(a-xb)计算ClO4-的中心原子Cl的价层电子对数,再判断其空间构型;
(2)![]() 含有4个原子,10个电子,据此书写与
含有4个原子,10个电子,据此书写与![]() 互为等电子体的阳离子;同一周期,从左到右,元素的第一电离能逐渐增大,但第IIA族、第VA族元素的第一电离能大于相邻元素判断C、N、O第一电离能的大小顺序;
互为等电子体的阳离子;同一周期,从左到右,元素的第一电离能逐渐增大,但第IIA族、第VA族元素的第一电离能大于相邻元素判断C、N、O第一电离能的大小顺序;
(3)根据![]() 为平面结构判断N原子的杂化方式;
为平面结构判断N原子的杂化方式;
(4)根据![]() 立方晶胞的示意图,
立方晶胞的示意图,![]() 位于晶胞的顶点和面心,
位于晶胞的顶点和面心,![]() 位于晶胞体内,而且
位于晶胞体内,而且![]() 与周围的4个
与周围的4个![]() 构成正四面体结构,
构成正四面体结构,![]() 位于体心,据此画出
位于体心,据此画出![]() 的位置示意图;
的位置示意图;
(5) 原子1位于晶胞左侧面的面心,坐标是(![]() ,0,
,0,![]() ),判断出坐标原点,再结合原子2位于晶胞底面的面心判断原子2的坐标。
),判断出坐标原点,再结合原子2位于晶胞底面的面心判断原子2的坐标。
【详解】
(1)Co为27号元素,基态Co原子电子排布式为1s22s22p63s23p63d74s2或[Ar] 3d74s2,则价层电子排布式为3d74s2;O为8号元素,基态O原子核外电子占据最高能级的电子为2p电子,电子云轮廓图形状为纺锤形;ClO4-的中心原子Cl的价层电子对数为4+![]() =4,空间构型为正四面体,故答案为:3d74s2;纺锤形;正四面体;
=4,空间构型为正四面体,故答案为:3d74s2;纺锤形;正四面体;
(2)![]() 含有4个原子,10个电子,与
含有4个原子,10个电子,与![]() 互为等电子体的阳离子为H3O+;同一周期,从左到右,元素的第一电离能逐渐增大,但N最外层为半充满状态,较稳定,第一电离能最大,则
互为等电子体的阳离子为H3O+;同一周期,从左到右,元素的第一电离能逐渐增大,但N最外层为半充满状态,较稳定,第一电离能最大,则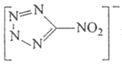 中所含各元素第一电离能由大到小的顺序为N>O>C,故答案为:H3O+;N>O>C;
中所含各元素第一电离能由大到小的顺序为N>O>C,故答案为:H3O+;N>O>C;
(3)![]() 为平面结构,结构为
为平面结构,结构为 ,则N原子的杂化方式为sp2杂化,故答案为:sp2;
,则N原子的杂化方式为sp2杂化,故答案为:sp2;
(4)根据![]() 立方晶胞的示意图,
立方晶胞的示意图,![]() 位于晶胞的顶点和面心,
位于晶胞的顶点和面心,![]() 位于晶胞体内,而且
位于晶胞体内,而且![]() 与周围的4个
与周围的4个![]() 构成正四面体结构,
构成正四面体结构,![]() 位于体心,因此
位于体心,因此![]() 的位置为
的位置为 ,故答案为:
,故答案为: ;
;
(5) 原子1位于晶胞左侧面的面心,坐标是(![]() ,0,
,0,![]() ),则坐标原点如图(
),则坐标原点如图(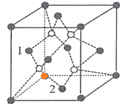 );原子2位于晶胞底面的面心,则坐标是(
);原子2位于晶胞底面的面心,则坐标是(![]() ,
,![]() ,0),故答案为:(
,0),故答案为:(![]() ,
,![]() ,0)。
,0)。
【点睛】
本题的易错点和难点为(4),要注意![]() 与周围的4个
与周围的4个![]() 构成正四面体结构,而且
构成正四面体结构,而且![]() 位于正四面体的体心,因此俯视图中
位于正四面体的体心,因此俯视图中![]() 位于4个
位于4个![]() 构成的正方形的中心。
构成的正方形的中心。


 )、半充满(
)、半充满( )和全空(
)和全空(
 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。