NA代表阿伏加德罗常数,下列叙述错误的是( )
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2===2HCl+O2反应中,每生成32 g氧气,则消耗NA个Cl2分子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50 mol·L-1 NaCl溶液与2 L 0.25 mol·L-1 Na2CO3溶液含Na+的物质的量不同
答案
A
【解析】
因为稀释以后,硫酸溶液的密度变小,![]() 硫酸)
硫酸)![]() 硫酸),而溶质硫酸的质量不变,故质量分数大于
硫酸),而溶质硫酸的质量不变,故质量分数大于![]() ,A错误;32 g氧气的物质的量为:
,A错误;32 g氧气的物质的量为: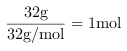 ,根据反应H2O2+Cl2===2HCl+O2可以知道,生成
,根据反应H2O2+Cl2===2HCl+O2可以知道,生成![]() 氧气消耗
氧气消耗![]() 氯气,即消耗NA个Cl2分子,B正确;标准状况下,分子数为NA的CO、C2H4混合气体物质的量为
氯气,即消耗NA个Cl2分子,B正确;标准状况下,分子数为NA的CO、C2H4混合气体物质的量为![]() ,气体体积约为22.4 L,质量为:
,气体体积约为22.4 L,质量为:![]() g,C正确;1 L、 0.50 mol·L-1 NaCl溶液中含有0.5mol钠离子,2 L 0.25 mol·L-1 Na2CO3溶液含Na+ 为1 mol,两溶液中含
g,C正确;1 L、 0.50 mol·L-1 NaCl溶液中含有0.5mol钠离子,2 L 0.25 mol·L-1 Na2CO3溶液含Na+ 为1 mol,两溶液中含![]() 的物质的量不同,D正确;正确选项A。
的物质的量不同,D正确;正确选项A。
