SO2 和 NOx 都是大气污染物。
(1)利用氨水可以将 SO2 和 NO2 吸收,原理如下图所示:

NO2 被吸收的离子方程式是__________________。
(2)湿法吸收工业尾气中的NO2,常选用纯碱溶液,将NO2转化为两种氮元素的常见含氧酸盐,其反应的离子方程式是(已知酸性HNO2>H2CO3)______________。
(3)用高能电子束激活烟气(主要成分是SO2、NO2、H2O等),会产生O3等强氧化性微粒。烟气经下列过程可获得化肥。

该化肥中含有的离子是![]() 、___________(填离子符号)。
、___________(填离子符号)。
(4)SCR 和 NSR 技术可有效降低柴油发动机在空气过量条件下的 NOx 排放。
I.SCR(选择性催化还原)工作原理:

①尿素[CO(NH2)2]水溶液热分解为 NH3 和 CO2,该反应的化学方程式是________________。
②反应器中 NH3 还原 NO2 的化学方程式是_________________。
③当燃油中含硫量较高时,尾气中 SO2 在 O2 作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4 的形成_____________________。
II.NSR(NOx 储存还原)工作原理:NOx 的储存和还原在不同时段交替进行,如下图所示。
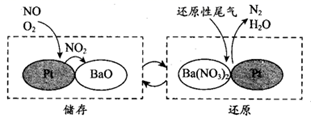
①通过 BaO 和 Ba(NO3)2 的相互转化实现 NOx 的储存和还原。储存 NOx 的物质是___________________,生成 Ba(NO3)2 的化学方程式是 _______________。
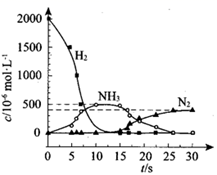
②用 H2 模拟尾气中还原性气体研究了 Ba(NO3)2 的催化还原过程,该过程分两步进行,下图表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2 与 Ba(NO3)2 的物质的量之比是___________。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与 NO 有关。在有氧气条件下 15NO 与 NH3 以一定比例反应时,得到的笑气几乎都是 15N1.5N0.5O。将该反应的化学方程式补充完整:_____________ ![]() _________15N1.5N0.5O+________H2O
_________15N1.5N0.5O+________H2O
答案
2NO2+4![]() =N2+4
=N2+4![]() +4H+
+4H+ ![]() +2NO2=
+2NO2=![]() +
+![]() +CO2
+CO2 ![]() 、
、![]() CO(NH2)2+H2O
CO(NH2)2+H2O![]() 2NH3↑+CO2↑ 8NH3+6NO2
2NH3↑+CO2↑ 8NH3+6NO2![]() 7N2+12H2O 2SO2+O2+4NH3+2H2O═2(NH4)2SO4 BaO 2BaO+4NO+3O2=2Ba(NO3)2 8:1 1215NO+4NH3+O2 8 6
7N2+12H2O 2SO2+O2+4NH3+2H2O═2(NH4)2SO4 BaO 2BaO+4NO+3O2=2Ba(NO3)2 8:1 1215NO+4NH3+O2 8 6
【解析】
(1) 根据流程图信息NO2被吸收时反应物为NO2、NH4HSO3,生成物有氮气,据此依据氧化还原反应的得失电子守恒、原子守恒和电荷守恒书写离子反应方程式;
(2) 纯碱溶液,将NO2转化为两种氮元素的常见含氧酸盐,结合原子守恒和氧化还原反应电子守恒分析反应生成硝酸盐和亚硝酸盐;
(3) 用高能电子束激活烟气(主要成分是SO2、NO2、H2O等),会产生O3等强氧化性微粒,O3与烟气中的SO2、NO2、H2O反应生成的H2SO4和HNO3与注入的NH3反应,生成化肥硫铵和硝铵;
(4) I.先判断反应物和生成物,再结合电子守恒和原子守恒书写有关反应方程式;
II.①由图可知储存NOx的物质是BaO;
②第一步反应中H2被氧化生成水,氢元素化合价由0价升高到+1价,Ba(NO3)2的N元素化合价由+5价降低到-3价,生成氨气,结合得失电子数目相等计算;
③在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15N1.5N0.5O,由N元素守恒可知15NO与NH3应为3:1,结合电子得失相等配平。
【详解】
(1) NO2被吸收时,反应物为NO2、NH4HSO3,二氧化氮中氮元素为+4价,生成物有氮气,所以亚硫酸氢根离子中硫被氧化成硫酸根离子,根据得失电子守恒、原子守恒和电荷守恒,反应的离子方程式为2NO2+4![]() =N2+4
=N2+4![]() +4H+;
+4H+;
(2) 纯碱溶液,将NO2转化为两种氮元素的常见含氧酸盐,结合原子守恒和氧化还原反应电子守恒分析反应生成硝酸盐和亚硝酸盐,反应的离子方程式为:![]() +2NO2=
+2NO2=![]() +
+![]() +CO2;
+CO2;
(3) 用高能电子束激活烟气(主要成分是SO2、NO2、H2O等),会产生O3等强氧化性微粒,O3与烟气中的SO2、NO2、H2O反应生成的H2SO4和HNO3与加入的NH3发生如下反应:H2SO4+2NH3=(NH4)2SO4、HNO3+NH3 =NH4NO3,该化肥中含有的离子是![]() 、
、![]() 、
、![]() ;
;
(4) I.①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,反应物为尿素和水,生成物为氨气和二氧化碳,根据原子守恒,反应的化学方程式为:CO(NH2)2+H2O![]() 2NH3↑+CO2↑;
2NH3↑+CO2↑;
②NH3在催化剂作用下还原NO2生成氮气和水,根据得失电子守恒和原子守恒,反应的化学方程式为8NH3+6NO2![]() 7N2+12H2O;
7N2+12H2O;
③SO2在O2作用下与NH3、H2O反应形成(NH4)2SO4,此反应中SO2是还原剂,氧气是氧化剂,根据得失电子守恒和原子守恒,反应的化学方程式为2SO2+O2+4NH3+2H2O═2(NH4)2SO4;
II.①由图示可知BaO和NOx反应生成Ba(NO3)2,Ba(NO3)2再还原为N2,则储存NOx的物质为BaO;储存时,氧化钡、一氧化氮和氧气反应生成 Ba(NO3)2的化学方程式是2BaO+4NO+3O2=2Ba(NO3)2;
②第一步反应中H2被氧化生成水,H元素的化合价由0价升高到+1价,Ba(NO3)2的N元素化合价由+5价降低到-3价,生成氨气,则1molBa(NO3)2生成氨气得到16mol电子,参加反应的氢气的物质的量为![]() mol=8mol,则消耗的H2与Ba(NO3)2的物质的量之比是8:1;
mol=8mol,则消耗的H2与Ba(NO3)2的物质的量之比是8:1;
③在有氧气条件下15NO 与 NH3以一定比例反应时,得到的笑气几乎都是15N1.5N0.5O,由N元素守恒可知15NO与NH3应为3:1,1mol 15NO被还原得到1mol电子,若有3mol15NO参与反应,则3mol15NO被还原得到3mol电子,1molNH3被氧化失去4mol电子,根据电子守恒,参与反应的O2为0.25mol,即15NO、NH3、O2物质的量之比为3mol:1mol:0.25mol=12:4:1,可知反应的化学方程式为1215NO+4NH3+O2![]() 815N1.5N0.5O +6H2O。
815N1.5N0.5O +6H2O。
【点睛】
配平氧化还原反应的一般步骤:①标好价:正确标出反应前后化合价有变化的元素的化合价;②列变化:列出元素化合价升高和降低的数值;③求总数:求元素化合价升高数和降低数的总数,确定氧化剂、还原剂、氧化产物、还原产物的化学计量数;④配系数:用观察法配平其他各物质的化学计量数;⑤细检查:利用“守恒”三原则(即质量守恒、得失电子守恒、电荷守恒),逐项检查配平的方程式是否正确。


