在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是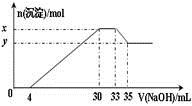
A.x – y = 0.01mol
B.原溶液中c(Cl-)="0.75" mol·L-1
C.原溶液的pH=1
D.原溶液中n(Mg2+)∶n(Al3+)=5∶1
答案
B
【解析】
由给出的离子在滴入NaOH溶液时发生H++OH-═H2O,Mg2+、Al3+结合OH-生成沉淀,NH4+与OH-反应,氢氧化铝与OH-反应而溶解,并结合图象可知,0~4mL时发生酸碱中和,4~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应,30~33mL发生NH4+与OH-反应,33~35mL发生氢氧化铝的溶解反应,然后利用离子反应方程式来计算解答.
【详解】
A.由图及离子反应可知x-y的值即为Al(OH)3的物质的量,则设Al(OH)3的物质的量为n,

![]() ,解得n=0.01mol,即x-y=0.01mol,故A正确;
,解得n=0.01mol,即x-y=0.01mol,故A正确;
B.由图可知,加入33mLNaOH溶液时溶液中的溶质只有NaCl,Na+由NaOH提供,所以n(Na+)=n(Cl-)=33×0.001L×5mol•L-1=0.165mol,则原溶液中Cl-的物质的量浓度为![]() =0.825mol/L,故B错误;
=0.825mol/L,故B错误;
C.由图可知0~4mL时发生H++OH-═H2O,则H+的物质的量为4mL×0.001L×5mol•L-1=0.02mol,H+的物质的量浓度为![]() =0.1mol/L,则pH=1,故C正确;
=0.1mol/L,则pH=1,故C正确;
D.由4~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应,根据反应Al3++3OH-═Al(OH)3↓,Al3+消耗的OH-的物质的量为n(OH-)=3n(Al3+)=0.01mol×3=0.03mol,所以Mg2+消耗的OH-的物质的量为(30-4)mL×0.001L×5mol•L-1-0.03mol =0.1mol,所以n(Mg2+)=0.05mol,则原溶液中n(Mg2+):n(Al3+)=0.05:0.01=5:1,故D正确;
故答案为B。







 ,HClO具有强氧化性,漂白剂不用氯水,而是用Cl2制成漂白粉的原因是便于贮存运输。
,HClO具有强氧化性,漂白剂不用氯水,而是用Cl2制成漂白粉的原因是便于贮存运输。
