以氢氧化物为负载的钉(Ru)催化剂对化学合成具有重要应用价值。将氢化物引入钙钛矿催化剂载体中形成氢氧化物负载,可有效防止钉催化剂氢中毒并增加反应活性。回答下列问题:
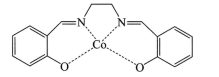
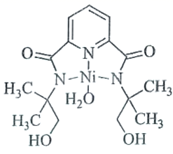
(1)一种具有催化作用的钌配合物结构如图所示。
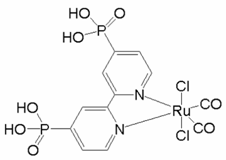
①在元素周期表中,钌元素与铁元素同族,则釕元素位于_____区。
②该配合物中,N原子的杂化方式为______,Ru的配位原子在空间中共同构成____结构(填标号)。
A 平面六边形 B 三角双锥 C 八面体 D 三棱柱
③该配合物中第二周期元素原子第一电离能由大到小的顺序为________ (用元素符号表示)。
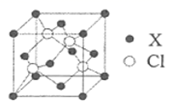
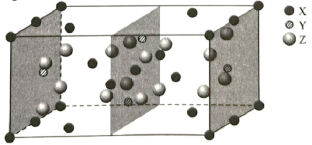
(2)钙钛矿是自然界中的一种常见矿物,其晶体属立方品系,密度为ρ g/cm3,某种钙钛矿的晶胞结构如图所示。

①NA为阿伏加德罗常数的值,晶胞中氧离子之间的最短距离为_______cm(用含ρ和NA的代数式表示)。
②一种无金属钙钛矿MDABCO-NH4L的晶胞结构与钙钛矿相同。若在MDABCO-NH4I3的晶胞中MDABCO的分数坐标为(0,0,0),I-的一种分数坐标为(![]() ,
,![]() ,0),则NH
,0),则NH![]() 的分数坐标为_______,与MDABCO距离最近的I-有__________个。
的分数坐标为_______,与MDABCO距离最近的I-有__________个。
答案
d sp2 C N>O>C ![]() (
(![]() ,
,![]() ,
,![]() ) 12
) 12
【解析】
(1)根据原子的结构特点和配位化合物及电离能的知识点解答。
(2)该晶胞为正方体,根据晶胞知识作答。
【详解】
(1)①Fe的核外电子排布式为1s22s22p63s23p63d64s2,最后一个电子排在d区,属于d区元素,所以釕元素位于d区;
②N原子旁边已形成8电子稳定结构,无孤电子对,含有3个σ键,所以其杂化方式为sp2,Ru的配位原子有6个,构成一个八面体,故选C;
③该化合物中第二周期元素有C、N和O三种元素,同周期从左到右元素的第一电离能逐渐增大,而第二主族的大于第三主族,第五主族的大于第六主族的,故三种元素的第一电离能的大小顺序为N>O>C;
(2)①该晶胞的化学式为CaTiO3,设晶胞的边长为acm,则有a3×ρ =136÷NA,面对角线=√2a,相交两边上的O距离最近,距离等于√2a/2,故最近的O原子的距离为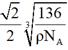 ;
;
②比较两者的化学式可知MDABCO相似于Ti4+,I-相似于O2-,则NH4+相似于Ca2+,Ca2+处于体心,其坐标为(![]() ,
,![]() ,
,![]() ),故NH4+的坐标为(
),故NH4+的坐标为(![]() ,
,![]() ,
,![]() )。由晶胞可知距Ti4+最近的O2-有3×8÷2=12个,MDABCO距离最近的I-也是12个。
)。由晶胞可知距Ti4+最近的O2-有3×8÷2=12个,MDABCO距离最近的I-也是12个。