室温下,[Cu(NH3)4](NO3)2与液氨混合并加入Cu可制得一种黑绿色晶体。
(1)基态Cu核外电子排布式是___________________。
(2)黑绿色晶体的晶胞如图所示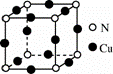 ,写出该晶体的化学式_________。
,写出该晶体的化学式_________。
(3)不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为___________ (用“→”标出其中 的配位键)。
(4)![]() 中N原子轨道的杂化类型是______________。 1 mo[Cu(NH3)4](NO3)2中含有的σ键数目为_______ 。
中N原子轨道的杂化类型是______________。 1 mo[Cu(NH3)4](NO3)2中含有的σ键数目为_______ 。
(5)液氨可作制冷剂,汽化时吸收大量热量的原因是______________。
答案
[Ar]3dl04s1 Cu3N ![]()
sp2杂化 22mol NH3分子之间有氢键
【解析】
(1)铜的原子序数是29,则根据核外电子排布规律可知,基态Cu的核外电子排布式为[Ar]3dl04s1;
(2) 根据均摊法可知,一个晶胞中含有12× 0.25 =3个Cu,8× 0.125=1 个N,故该晶体的化学式为Cu3N;
(3)[Cu(NH3)4]2+配合物中,铜原子提供空轨道,NH3中氮原子提供孤电子对,Cu2+与4个NH3形成配位键,配位键由提供孤电子对的原子指向提供空轨道的原子,所以其表示方法为:![]() ;
;
(4)NO3-中N原子价层电子对个数是3,且不含孤电子对,所以N原子采用sp2杂化;1 mo[Cu(NH3)4](NO3)2 中含有的σ键数目为22mol;
(5) 液氨可作制冷剂,汽化时吸收大量热量的原因是NH3分子间存在氢键,汽化时克服氢键,需要消耗大量能量。


 )、半充满(
)、半充满( )和全空(
)和全空(
 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。