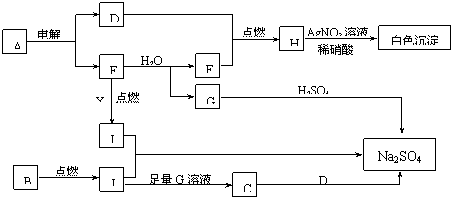
下列实验装置用加热铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是( )
A.制取并收集二氧化硫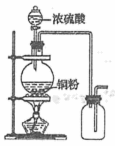
B.向反应后的混合物中加水稀释
C.过滤出稀释后混合物中的不溶物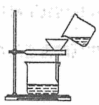
D.将硫酸铜溶液蒸发浓缩后冷却结晶
答案
D
【解析】
A. 浓硫酸和铜反应需要加热,生成的二氧化硫的密度比空气密度大,且属于有毒气体,应采用向上排空气法,后加尾气处理装置,图中为向下排空气法,A错误;
B. 浓硫酸溶于水放出大量的热,浓硫酸的稀释均是把浓硫酸加入水中,并不断搅拌;由于反应后的混合物仍然可能含有浓硫酸,所以应把混合物向中水倾倒并不断搅拌,B错误;
C. 过滤时应使用滤纸,用玻璃棒引流,C错误;
D. 硫酸铜性质稳定,可用蒸发皿蒸发结晶,D正确。
答案为D。


 2SO3
2SO3





 无色溶液
无色溶液 恢复原色。
恢复原色。


 ,如下数轴所示:
,如下数轴所示:
 则固体物质为Na2SO3,
则固体物质为Na2SO3, ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3. ,则同体物质为NaHSO3
,则同体物质为NaHSO3 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3, ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。