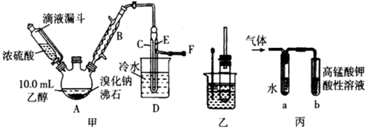
某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:

I. 溴乙烷的制备
反应原理如下,实验装置如上图(加热装置、夹持装置均省略):
H2SO4+NaBr ![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
(1) 图甲中A 仪器的名称_____,图中B 冷凝管的作用为_____。
(2) 若图甲中A 加热温度过高或浓硫酸的浓度过大,均会使 C 中收集到的粗产品呈橙色,原因是A 中发生了副反应生成了_____;F 连接导管通入稀NaOH 溶液中,其目的主要是吸收_____等尾气防止污染空气
II. 溴乙烷性质![]() 探究
探究
用如图实验装置验证溴乙烷的性质:
(3) 在乙中试管内加入 10mL6mol·L -1NaOH 溶液和 2mL 溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为_______。
(4) 若将乙中试管里的 NaOH 溶液换成NaOH 乙醇溶液,为证明产物为乙烯,将生成的气体通入如图丙装置。a 试管中的水的作用是_______;若无 a 试管,将生成的气体直接通入 b 试管中,则 b中的试剂可以为 _____。
答案
(1). 三颈烧瓶 (2). 冷凝回流,增加反应物利用率 (3). Br2 (4). SO2、Br2、HBr (5). CH3CH2Br+NaOH![]() CH3CH2OH+NaBr (6). 吸收乙醇 (7). 溴水(或溴的CCl4溶液)
CH3CH2OH+NaBr (6). 吸收乙醇 (7). 溴水(或溴的CCl4溶液)
【解析】
装置甲中通过浓硫酸和溴化钠反应生成溴化氢,然后利用溴化氢和乙醇反应制备溴乙烷,因浓硫酸具有强氧化性,可能将溴化钠氧化生成溴单质,使溶液呈橙色,冷凝管进行冷凝回流,然后利用冷水冷却进行收集溴乙烷;溴乙烷能够与氢氧化钠溶液发生取代反应生成乙醇,溴乙烷能够在NaOH乙醇溶液、加热条件下发生消去反应生成乙烯,乙烯能够使酸性高锰酸钾溶液褪色,但需要注意除去乙烯气体中混有的乙醇,需要除去乙醇,以此解答本题。
【详解】I.(1)仪器A为三颈烧瓶;乙醇易挥发,冷凝管的作用为冷凝回流,增加反应物利用率;
(2)若图甲中A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,考虑到浓硫酸具有强氧化性,反应温度过高会使反应剧烈,产生橙色的Br2,发生反应的化学方程式为:2HBr+H2SO4(浓)=Br2+SO2+2H2O;F连接导管通入稀NaOH溶液中,考虑到反应产生SO2,Br2,HBr气体,会污染大气,应用NaOH溶液吸收,则其目的主要是:吸收SO2,Br2,HBr,防止污染空气;
II.(3)溴乙烷不溶于水,一开始出现分层,当加入NaOH溶液水浴加热发生反应,产生NaBr和乙醇,反应为:CH3CH2Br+NaOH![]() CH3CH2OH+NaBr;
CH3CH2OH+NaBr;
(4)为证明溴乙烷在NaOH乙醇溶液中反应的气体产物为乙烯,将生成的气体通入如图丙装置,随着反应的发生,产生的乙烯中可能会混有乙醇,乙醇也能使酸性高锰酸钾溶液褪色,则应先除去混有的乙醇,再验证乙烯,所以a试管中的水的作用是:吸收乙醇,若无a试管,b试管中的试剂应为能与乙烯反应而不与乙醇反应,可考虑溴水(或溴的CCl4溶液),故答案为:吸收乙醇;溴水(或溴的CCl4溶液)。


 2CO2+3H2O
2CO2+3H2O  )就不能发生消去反应。能发生消去反应的醇的结构特点为:
)就不能发生消去反应。能发生消去反应的醇的结构特点为:



 作为示踪原子来确定反应机理。如:
作为示踪原子来确定反应机理。如: