铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
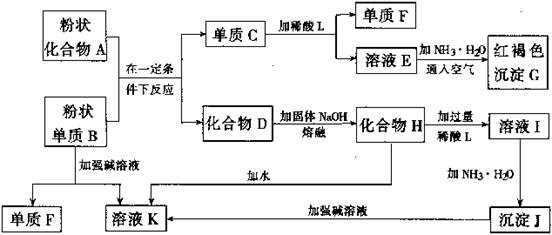
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________
②检验滤液B中是否还含有铁元素的方法为:_________________________
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________(填操作名称)、过滤、洗涤。
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________。
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________。
答案
(1). 2Fe2++1ClO-+5H2O=2Fe(OH)3↓+1C1-+4H+ (2). 取少量滤液B,加入KSCN溶液,若不变红,说明滤液B中不含铁元素;若变红,说明滤液B中含铁元素(其他合理答案均得分) (3). c (4). 冷却结晶 (5). Al3++3H2O ![]() Al(OH)3(胶体)+3H+ (6). 2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓
Al(OH)3(胶体)+3H+ (6). 2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓
【解析】
(1). ①滤液A中含有氯化铁和氯化亚铁、氯化铝,加入漂白液,目的是氧化除铁,所得滤液B显酸性,说明生成了氢离子,次氯酸根离子具有氧化性氧化亚铁离子生成铁离子,在溶液中形成氢氧化铁沉淀除去,次氯酸根离子被还原为氯离子,根据电子守恒和电荷守恒分析,所以反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+,故答案为 2Fe2++1ClO-+5H2O=2Fe(OH)3↓+1C1-+4H+ ; ②滤液B中是否含有铁元素的方法为利用铁离子的检验方法进行,铁离子遇到硫氰化钾显红色,所以答案为: 取少量滤液B,加入KSCN溶液,若不变红,说明滤液B中不含铁元素;若变红,说明滤液B中含铁元素(其他合理答案均得分);③ 滤液B 中铝元素以铝离子形式存在,将其转化为沉淀需要加入氨水,加入氢氧化钠不好控制其物质的量多少,因为氢氧化铝可以溶于氢氧化钠,故答案为c; ④滤液B制备氯化铝晶体涉及的的方法为重结晶,将溶液加热浓缩,然后冷却结晶,过滤、洗涤、干燥即可得氯化铝晶体,故答案为冷却结晶;Ⅱ、 (1) 明矾净水是明矾中的铝离子水解生成氢氧化铝胶体具有吸附作用,故答案为Al3++3H2O ![]() Al(OH)3(胶体)+3H+ ;(2)将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,则2摩尔明矾需要6摩尔氢氧化钡,离子方程式为:2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓。故答案为2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓。
Al(OH)3(胶体)+3H+ ;(2)将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,则2摩尔明矾需要6摩尔氢氧化钡,离子方程式为:2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓。故答案为2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓。
点睛:常用的离子检验的方法有:
颜色:铜离子为蓝色、铁离子为浅黄色、亚铁离子为浅绿色,高锰酸根离子为紫色。
硫酸根离子:加入盐酸酸化,再加入氯化钡溶液,产生白色沉淀。
氯离子:加入稀硝酸酸化,再加入硝酸银溶液,产生白色沉淀。
碳酸根离子:加入氯化钙,产生白色沉淀,沉淀溶于盐酸产生无色无味的能使澄清的石灰水变浑浊的气体。
铝离子:加入氢氧化钠溶液,先产生沉淀后沉淀溶解。
铁离子:加入氢氧化钠溶液,生成红褐色沉淀,或加入硫氰化钾溶液,显红色,或加入苯酚,显紫色。

 。
。 C+MgO
C+MgO  MgO+H2O
MgO+H2O  2MgO
2MgO MgCl2
MgCl2  MgS
MgS Mg3N2
Mg3N2  Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq) Mg+Cl2↑
Mg+Cl2↑