已知A为淡黄色固体,R和T是两种生活中常见的金属单质,C、F是无色无味的气体。
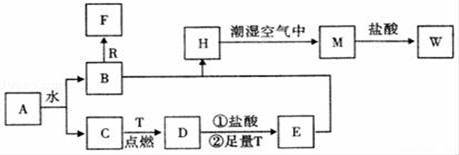
(1)物质A的化学式为_____,D化学式为_____,W的化学式为_____;
(2)B与R反应生成F的离子反应式为___________;
(3)A与CO2反应的化学反应方程式为____________;
(4)H转化为M的化学反应方程式为_____________;
答案
(1). Na2O2 (2). Fe3O4 (3). FeCl3 (4). 2Al+2OH﹣+2H2O=2AlO﹣2+3H2↑ (5). 2Na2O2+2CO2=2Na2CO3+O2 (6). 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
A为淡黄色固体,能与水反应,即A为Na2O2,Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,C为无色无味的气体,即C为O2,B为NaOH,R为常见金属单质,即R为Al,F为无色无味气体,即F为H2,T为两种生活中常见的金属单质,即T为Fe,D为Fe3O4,E为FeCl2,H为Fe(OH)2,M为Fe(OH)3,W为FeCl3;
【详解】A为淡黄色固体,能与水反应,即A为Na2O2,Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,C为无色无味的气体,即C为O2,B为NaOH,R为常见金属单质,即R为Al,F为无色无味气体,即F为H2,T为两种生活中常见的金属单质,即T为Fe,D为Fe3O4,Fe3O4与盐酸反应生成FeCl2和FeCl3,加入过量的Fe,Fe与FeCl3反应生成FeCl2,即E为FeCl2,H为Fe(OH)2,M为Fe(OH)3,W为FeCl3,
(1)根据上述分析,物质A为Na2O2,D的化学式为Fe3O4,W的化学式为FeCl3;
(2)Al与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)Na2O2与CO2反应![]() 方程式为2Na2O2+2CO2=2Na2CO3+O2;
方程式为2Na2O2+2CO2=2Na2CO3+O2;
(4)Fe(OH)2被氧气氧化成Fe(OH)3,其反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。