工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl + 2H2O![]() NaOH + Cl2↑+ H2↑
NaOH + Cl2↑+ H2↑
(1)用双线桥表示出电子转移的方向和数目______________题干中反应改写成离子方程式是___________________________________
(2)电解食盐水的过程中,氧化产物是__________________________________
(3)电解食盐水要求对粗食盐水进行精制,以除去租食盐水中含有的泥沙和SO42-、Ca2+,Mg2+等杂质离子。精制时依次加入氯化钡溶液、纯碱、烧碱,充分反应后过滤,在滤液中加入盐酸中和至中性。盐酸与滤液反应的离子方程式:___________________,________________________________.
(4)实验室欲用固体NaOH来配制90ml 0.5 mol/L的NaOH溶液来用于以上除杂,需要称量固体NaOH_______g。配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为__________。在配制过程中,若其它操作均正确,下列操作会引起结果偏低的是___________(填字母)。
A.没有洗涤烧杯和玻璃棒
B.未等NaOH溶液冷却至室温就转移到容量瓶中定容
C.容量瓶不干燥,含有少量蒸馏水
答案
(1).  (2). 2Cl—+2H2O
(2). 2Cl—+2H2O![]() 2OH—+Cl2↑+H2↑ (3). Cl2 (4). H+ +OH—=H2O (5). CO3 2- + 2H+ =H2O+ CO2↑ (6). 2.0 (7). ②①③⑧⑤⑥⑦④ (8). A
2OH—+Cl2↑+H2↑ (3). Cl2 (4). H+ +OH—=H2O (5). CO3 2- + 2H+ =H2O+ CO2↑ (6). 2.0 (7). ②①③⑧⑤⑥⑦④ (8). A
【解析】
(1)反应中氯化钠中氯元素的化合价升高生成氯气,氯化钠做还原剂,水中氢元素化合价降低生成氢气,水做氧化剂,反应中转移电子数目为2e—;
(2)反应中Cl元素化合价升高的被氧化,氯气为氧化产物;
(3)在滤液中加入盐酸,目的是除去溶液中过量的氢离子和碳酸根离子;
(4)根据n=cM计算出氢氧化钠的物质的量;根据配制一定物质的量浓度的溶液的配制步骤进行排序;分析操作对溶质的物质的量或对溶液的体积的影响,根据c=n/V判断。
【详解】(1)电解饱和食盐水生成氢气、氯气(Cl2)和烧碱,反应中氯化钠中氯元素的化合价升高生成氯气,氯化钠失电子做还原剂,水中氢元素化合价降低生成氢气,水得电子做氧化剂,反应中转移电子数目为2e—,双线桥为: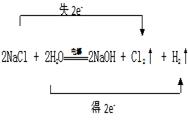 ;离子方程式为:2Cl—+2H2O
;离子方程式为:2Cl—+2H2O![]() 2OH—+Cl2↑+H2↑,故答案为
2OH—+Cl2↑+H2↑,故答案为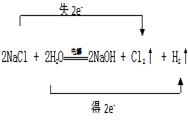 ;2Cl—+2H2O
;2Cl—+2H2O![]() 2OH—+Cl2↑+H2↑;
2OH—+Cl2↑+H2↑;
(2)反应中Cl元素化合价升高的被氧化,氯化钠失电子做还原剂,氯气为氧化产物,故答案为Cl2;
(3)精制时依次加入氯化钡溶液、纯碱、烧碱,氯化钡溶液除去硫酸根离子,纯碱除去钡离子、钙离子,烧碱除去镁离子;充分反应后过滤,在滤液中加入盐酸,目的是除去溶液中过量的氢离子和碳酸根离子,则在滤液中加入盐酸中和至中性的离子方程式为:H++OH-=H2O,CO3 2- + 2H+ =H2O+ CO2↑,故答案为H++OH-=H2O;CO3 2- + 2H+ =H2O+ CO2↑;
(4)实验室配制90ml 0.5 mol/L的NaOH溶液应选用100ml容量瓶,需氢氧化钠的质量为m=0.5L×0.1mol•L-1×40g/mol=2.0g,故答案为2.0g;
操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,实验先后顺序为②①③⑧⑤⑥⑦④,故答案为②①③⑧⑤⑥⑦④;
A、有洗涤烧杯和玻璃棒,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低;
B、液体具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,冷却后会导致溶液体积偏小,溶液浓度偏高;
C、容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变;
故答案为A。