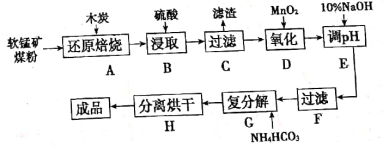
高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:

根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在 中加热;步骤C中的滤渣为 。
(2)步骤D中氧化剂与还原剂的物质的量之比为 。
(3)步骤E中调节pH的范围为 ,其目的是 。
(4)步骤G,温度控制在35℃以下的原因是 ,若Mn2+恰好沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol/L,则Ksp(MnCO3)= 。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是 。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300 g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中NO3-完全转化为NO2-);加入稍过量的硫酸铵,发生反应NO2-+NH4+=N2↑+2H2O以除去NO2-;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程为 。
②试样中锰元素的质量分数为 。
答案
(1)坩埚(1分) C和Cu(1分) (2)1∶2(1分)
(3)3.7≤pH<8.1(1分) 使Fe3+转化为Fe(OH)3而除去,而不影响Mn2+(2分)
(4)减少碳酸氢铵的分解,提高原料利用率 (1分) 2.2×10-11 (2分)
(5)取少量最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净(2分)
(6) ①6Fe2++Cr2O2-7+14H+===6Fe3++2Cr3++7H2O(2分) ②25%(2分)

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L