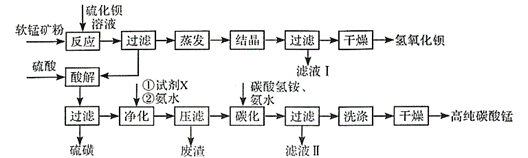
用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp |
|
|
|
|
回答下列问题
(1)软锰矿预先粉碎的目的是____________,MnO2与BaS溶液反应转化为MnO的化学方程式为________。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是________。
(3)滤液I可循环使用,应当将其导入到________操作中(填操作单元的名称)。
(4)净化时需先加入的试剂X为________(填化学式)。再使用氨水调溶液的pH,则pH的理论最小值为_______(当溶液中某离子浓度![]() 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为______________________。
答案
(1). 增大接触面积,充分反应,提高反应速率: (2). ![]() (3). 过量的MnO2消耗了产生的Ba(OH)2 (4). 蒸发 (5). H2O2 (6). 4.9 (7).
(3). 过量的MnO2消耗了产生的Ba(OH)2 (4). 蒸发 (5). H2O2 (6). 4.9 (7). ![]()
【解析】
【分析】
软锰矿粉(主要成分为MnO2,含少量Fe3O4、Al2O3)加入硫化钡溶液进行反应,主要发生MnO2+BaS+H2O=Ba(OH)2+MnO+S,过滤得到Ba(OH)2溶液,经蒸发结晶、过滤、干燥得到氢氧化钡;滤渣用硫酸溶解,得到的滤液中主要金属阳离子有Mn2+、Fe2+、Fe3+、Al3+,得到的滤渣为不溶于稀硫酸的硫磺;之后向滤液中加入合适的氧化剂将Fe2+转化为Fe3+,然后加入氨水调节pH,使Fe3+、Al3+转化为沉淀除去,压滤得到的废渣为Fe(OH)3和Al(OH)3,此时滤液中的金属阳离子只有Mn2+,向滤液中加入碳酸氢铵、氨水,Mn2+和碳酸氢根电离出的碳酸根结合生成碳酸锰沉淀,过滤、洗涤、干燥得到高纯碳酸锰。
【详解】(1)软锰矿预先粉碎可以增大反应物的接触面积,使反应更充分,提高反应速率;MnO2与BaS反应转化为MnO,Mn元素的化合价由+4价降低为+2价,根据元素价态规律可知-2价的S元素应被氧化得到S单质,则MnO2与BaS的系数比应为1:1,根据后续流程可知产物还有Ba(OH)2,结合元素守恒可得化学方程式为:MnO2+BaS+H2O=Ba(OH)2+MnO+S;
(2)根据题目信息可知MnO2为两性氧化物,所以当MnO2过量时,会消耗反应产生的Ba(OH)2,从而使Ba(OH)2的量达到最大值或会减小;
(3)滤液I为结晶后剩余的Ba(OH)2饱和溶液,所以可以导入到蒸发操作中循环使用;
(4)净化时更好的除去Fe元素需要将Fe2+氧化为Fe3+,为了不引入新的杂质,且不将Mn元素氧化,加入的试剂X可以是H2O2;根据表格数据可知,Fe(OH)3和Al(OH)3为同种沉淀,而Al(OH)3的Ksp稍大,所以当Al3+完全沉淀时,Fe3+也一定完全沉淀,当c(Al3+)=1.0×10-5mol/L时,c(OHˉ)=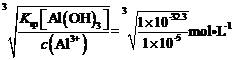 =10-9.1mol/L,所以c(H+)=10-4.9mol/L,pH=4.9,即pH的理论最小值为4.9;
=10-9.1mol/L,所以c(H+)=10-4.9mol/L,pH=4.9,即pH的理论最小值为4.9;
(5)碳化过程Mn2+和碳酸氢根电离出的碳酸根结合生成碳酸锰沉淀,促进碳酸氢根的电离,产生的氢离子和一水合氨反应生成铵根和水,所以离子方程式为Mn2++HCO![]() +NH3·H2O=MnCO3↓+NH
+NH3·H2O=MnCO3↓+NH![]() +H2O。
+H2O。