含氰根(CN−)的废水必须经处理后排放。某电镀废水pH≈12,氰化物以CN−、Cu(CN)32−等形式存在(均以CN−计),处理流程如下:
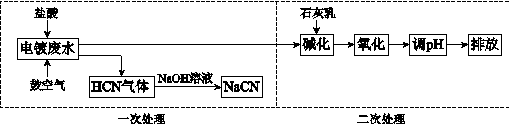 |
(1)HCN是一元弱酸,用离子方程式表示NaCN水溶液显碱性的原因:______。
(2)二次处理阶段,使用不同方法氧化。
①过硫酸钾(K2S2O8)氧化法:K2S2O8溶液将CN−(N为-3价)氧化成毒性弱的CNO−(N为-3价)。
Ⅰ.碱性溶液中S2O82−在一定条件下氧化CN−生成CNO−和SO42−的离子方程式是______。
Ⅱ.不同浓度的K2S2O8溶液对CN−的去除率如图1。工业上选用浓度为1 mmol·L−1
K2S2O8溶液,不用0.75 mmol·L−1和2 mmol·L−1的原因是______。
图1 CN−的去除率![]()


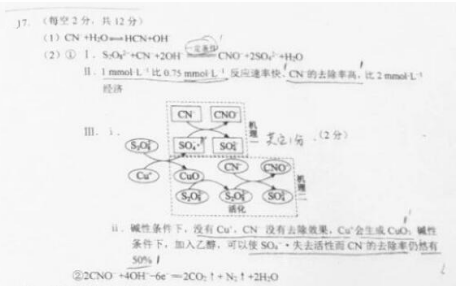
Ⅲ.研究CN−的氧化去除机理。(文献中为碱性条件下的结论)
文献:a.没有Cu+,S2O82−对CN−没有去除效果。
b.S2O82−和Cu+反应生成硫酸根自由基(SO4−·)和CuO。
c.SO4−·可能转变为羟基自由基(·OH)。
d.SO4−· 、·OH均可将CN−氧化为CNO−。叔丁醇只可以使·OH失
去活性,乙醇可以使SO4−· 、·OH均失去活性。
实验:相同条件下,向含Cu(CN)32−的碱性废水中加入叔丁醇,CN−的去除率没有影响;加入乙醇,CN−的去除率降低50%。
两种不同的CN−的氧化去除机理如图2,结合文献和实验回答下列问题:
ⅰ.补全“机理一”。
ⅱ.从“机理二”可看出CuO参与了去除CN−,列举其证据:______。
②电解法:碱性环境中,在阳极发生两步反应,CN−放电生成CNO−,CNO−再放电生成CO2和N2,第二步的阳极反应式是______。
答案