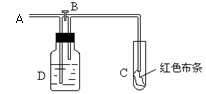
如图为氯及其化合物的“价-类”二维图。
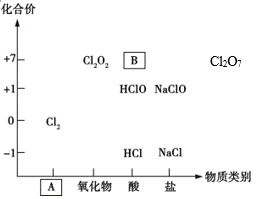
(1)填写二维图缺失的类别A_________和化学式B_________。
(2)某同学利用以下试剂研究HCl性质,进行了如下预测:
a.NaClO b.Fe c.NaOH d.KMnO4 e.AgNO3
从物质类别上看,HCl属于______,可能与__________发生反应(填序号);
从化合价角度看,Cl-具有______性,可能与_____发生反应(填序号)。
(3)某工厂用NaCl溶液制备氯气,其化学原理为如下反应:
![]() H2O +
H2O + ![]() NaCl == Cl2 +
NaCl == Cl2 + ![]() NaOH+
NaOH+![]()
①请将上述方程式补充完整,并用单线桥表示电子转移。_____________
②反应中NaCl作_________剂,理由是_________________________________。
答案
(1). 单质 (2). HClO4 (3). 酸 (4). a、b、c、e (5). 还原 (6). a、d (7). 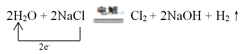 (8). 还原 (9). 因为其中氯由-1价上升为0价(或在反应中失去电子)
(8). 还原 (9). 因为其中氯由-1价上升为0价(或在反应中失去电子)
【解析】
【分析】
(1)Cl2为单质;根据B中Cl元素化合价进行判断;
(2)HCl属于强电解质,完全电离,所有的阳离子均为H+,因此HCl属于酸,能与碱、金属单质、等发生反应;Cl-中Cl为-1价,为最低价态,具有还原性,据此分析作答;
(3)①根据氧化还原反应化合价升降守恒对方程式进行配平,并判断电子转移数目;
②根据方程式中化合价的变化判断。
【详解】(1)Cl2为单质,因此A为单质;物质B中Cl为+7价,Cl为+7价的酸为HClO4;
(2)HCl属于强电解质,完全电离,所有的阳离子均为H+,因此HCl属于酸,能与NaClO反应生成HClO,能与铁反应生成氢气,能与氢氧化钠发生中和反应,能与AgNO3反应生成白色沉淀;Cl-中Cl为-1价,为最低价态,具有还原性,能与NaClO发生归中反应,能与KMnO4发生氧化还原反应;
(3)①根据氧化还原反应化合价升降守恒对方程式配平可得方程式为2H2O+2NaCl![]() Cl2+2NaOH+H2↑,2molNaCl参与反应,电子转移2mol,用单线桥表示为:
Cl2+2NaOH+H2↑,2molNaCl参与反应,电子转移2mol,用单线桥表示为:
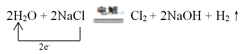 ;
;
②由方程式可知,反应中Cl由-1价变为0价,化合价升高,失去电子,被氧化,NaCl作还原剂。
【点睛】用单线桥表示电子得失时,要注意以下几点:
a.箭头从失电子元素的原子指向得电子元素的原子。
b.不标“得到”或“失去”,只标明电子转移的总数。
c.线桥只出现在反应物中。




 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。  2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。  HCl+HClO
HCl+HClO