中国是最早发现并使用青铜器![]() 国家。司母戊鼎是迄今为止出土的世界上最大、最重的青铜礼器,享有“镇国之宝”的美誉(如图1)。
国家。司母戊鼎是迄今为止出土的世界上最大、最重的青铜礼器,享有“镇国之宝”的美誉(如图1)。
(1)Cu原子的外围电子排布式为_____。
(2)图2所示为第四周期某主族元素的第一至五电离能数据,该元素是____,I3远大于I2的原因是______。
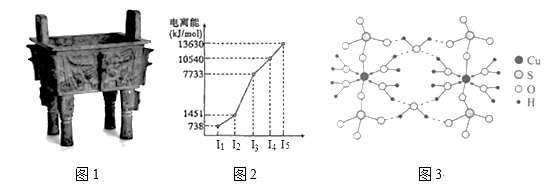
(3)图3是某含铜配合物的晶体结构示意图。
①晶体中H2O和SO42-的中心原子的杂化类型为_____,试判断H2O和SO42-的键角大小关系并说明原因_____。
②图3中的氢键有(H2O)O—H···O(H2O)和_______。
③写出该配合物的化学式_______。
(4)一种铜的氯化物晶胞结构如图所示。
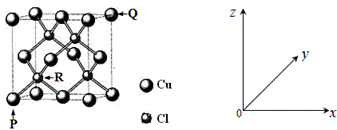
该化合物的化学式为______,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、(![]() ,
,![]() ,
,![]() ),若Cu原子与最近的Cl原子的核间距为apm,则该晶体的密度计算表达式为______。
),若Cu原子与最近的Cl原子的核间距为apm,则该晶体的密度计算表达式为______。
答案
(1). 3d104s1 (2). Ca(或钙) (3). Ca原子失去2个电子以后达到稳定结构,再失去1个电子很困难 (4). sp3、sp3 (5). H2O分子键角小于的SO42-键角,因为H2O中O存在2对孤电子对而SO42-中的S不存在,孤电子对成键电子的斥力大于成键电子对成键电子的斥力 (6). (H2O)O—H···O(SO42-) (7). [Cu(H2O)4]SO4·H2O (8). CuCl (9). ![]()
![]() g/cm3
g/cm3
【解析】
(1)Cu为第29号元素,原子的外围电子排布式为:3d104s1 ;
(2)根据图示第四周期某主族元素的第一至五电离能数据,电离能突变在第三电离能,故该元素为第四周期第IIA族元素,该元素是Ca;I3远大于I2的原因是Ca原子失去2个电子以后达到稳定结构,再失去1个电子很困难;
(3)①晶体中H2O和SO42-的价层电子对数均为4对,故中心原子的杂化类型均为sp3;H2O的键角小于SO42-的键角,因为H2O中O存在2对孤电子对而SO42-中的S没有孤对电子,孤电子对成键电子的斥力大于成键电子对成键电子的斥力,故键角更小;
②图3中的氢键有(H2O)O—H···O(H2O)和(H2O)O—H···O(SO42-);
③该配合物中,中心离子是Cu2+,配体是水,配位数是4,阴离子是硫酸根,还有一个结晶水,故其化学式为:[Cu(H2O)4]SO4·H2O;
(4)铜的氯化物晶胞结构中Cu占据了顶点和面心,Cl占据了体内4个位置,故该化合物的化学式为CuCl,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、 (![]() ,
,![]() ,
,![]() ),若Cu原子与最近的Cl原子的核间距为a pm,即为体对角线的四分之一,故则该晶体的边长为:
),若Cu原子与最近的Cl原子的核间距为a pm,即为体对角线的四分之一,故则该晶体的边长为:![]() ×10-10cm,该晶胞的体积为:
×10-10cm,该晶胞的体积为:![]() ×10-30cm3,一个晶胞的质量为:
×10-30cm3,一个晶胞的质量为:![]() g,故晶胞的密度计算表达式为:
g,故晶胞的密度计算表达式为: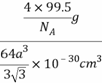 =
= ![]()
![]() g/cm3。
g/cm3。



 Au顺序,金属性逐渐减弱。
Au顺序,金属性逐渐减弱。  ,说明溴的非金属性比碘强。
,说明溴的非金属性比碘强。  ,说明O 的非金属性强于S。
,说明O 的非金属性强于S。 CuCl2,所以C1的非金属性强于S。
CuCl2,所以C1的非金属性强于S。 

 (上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。
(上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。  。
。 的半径大小,可找出与A13+电子数相同,与S同主族的氧元素的阴离子
的半径大小,可找出与A13+电子数相同,与S同主族的氧元素的阴离子 进行比较,半径:
进行比较,半径: ,且
,且