锌铜原电池装置如图所示,下列说法正确的是
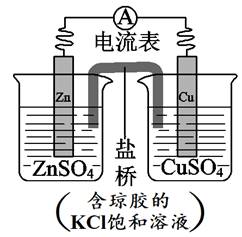
A. 铜电极上发生氧化反应
B. 电流从锌片流向铜片
C. 盐桥中K+向负极移动
D. 锌电极上发生的反应:Zn − 2e- == Zn2+
答案
【答案】D
【解析】
【分析】
该装置为原电池装置,发生的反应为Zn+Cu2+=Zn2++Cu,则Zn电极作负极,电极反应为Zn-2e-=Zn2+,Cu电极作正极,电极反应为Cu2++2e-=Cu。
【详解】A、Cu电极作正极,发生还原反应,A错误;
B、Cu电极作正极,Zn电极作负极,则电流由铜片流向锌片,B错误;
C、电流在外电路中由正极流向负极,则盐桥中K+向正极移动,C错误;
D、Zn电极作负极,电极反应为Zn-2e-=Zn2+,D正确;
故选D。
