高铁酸钾(K2FeO4)是一种新型的污水处理剂。
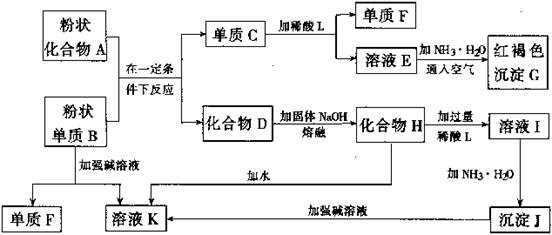
(1)K2FeO4![]() 制备:
制备:
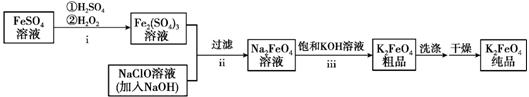
①i中反应的离子方程式是_______。
② 将ii中反应的离子方程式补充完整:____Fe3+ +____OH- +____ClO-=____FeO42-+_______+________
③ iii中反应说明溶解度:Na2FeO4_______K2FeO4(填“>”或“< ”)。
(2)K2FeO4的性质:
i. 将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应。
ii. 将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
iii. 将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比i快。
① K2FeO4溶于蒸馏水的化学反应方程式是_______。
② K2FeO4的氧化性与溶液pH的关系是_______。
(3)K2FeO4的应用。K2FeO4可用于生活垃圾渗透液的脱氮(将含氮物质转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如下:
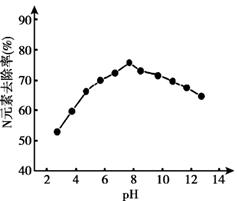
① K2FeO4脱氮的最佳pH是_____。
② 根据图推测,pH = 4时生活垃圾渗透液中含氮物质主要以______形式存在。
③ pH大于8时,脱氮效果随pH的升高而减弱,分析可能的原因:_______。
答案
【答案】 (1). 2Fe2+ +H2O2 + 2H+ = 2Fe3+ + 2H2O (2). 2 (3). 10 (4). 3 (5). 2 (6). 3Cl- (7). 5H2O (8). > (9). 4K2FeO4 +10H2O = 4Fe(OH)3(胶体) + 3O2↑ + 8KOH (10). pH越小,氧化性越强 (11). pH≈8 (12). NH4+ (13). pH>8的溶液,随pH增大,K2FeO4氧化性减弱,不利于将含氮物质氧化
【解析】
【分析】
将硫酸亚铁与酸性过氧化氢溶液反应,得到硫酸铁,硫酸铁与氢氧化钠和次氯酸钠发生氧化还原反应,得到高铁酸钠,再加入氢氧化钾,可以到到高铁酸钾;
(1)①i中是2Fe2+ 和酸性H2O2溶液发生氧化还原反应;
②根据电荷守恒和元素守恒完成并配平离子方程式;
③ iii中由高铁酸钠溶液转化为高铁酸钾粗品,说明溶解度减小;
(2)①根据K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应的现象,完成化学方程式。
②根据将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比i快的现象,得出pH越小,氧化性越强;
(3)①根据图像,pH≈8时,K2FeO4脱氮率最高;
②图像可以得出,pH = 4时,氮元素的去除率为百分之六十,生活垃圾渗透液的脱氮(将含氮物质转化为N2)生活垃圾中的含氮物质为NH4+;
③由于pH越小,高铁酸钾的氧化性越强,则PH增大,会使高铁酸钾的氧化性减弱;
【详解】将硫酸亚铁与酸性过氧化氢溶液反应,得到硫酸铁,硫酸铁与氢氧化钠和次氯酸钠发生氧化还原反应,得到高铁酸钠,再加入氢氧化钾,可以到到高铁酸钾;
(1).①i中是2Fe2+ 和酸性H2O2溶液发生氧化还原反应,2Fe2++H2O2+2H+ =2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②根据电荷守恒和元素守恒完成并配平离子方程式, 2Fe3+ +10OH- +3ClO-=2FeO42-+ 3Cl- +5H2O,
故答案为:2;10;3;2;3Cl-;5H2O;
③iii中由高铁酸钠溶液转化为高铁酸钾粗品,说明溶解度减小,
故答案为:>;
(2).①将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应根据现象写出化学方程式4K2FeO4 +10H2O = 4Fe(OH)3(胶体) + 3O2↑ + 8KOH,
故答案为:4K2FeO4 +10H2O = 4Fe(OH)3(胶体) + 3O2↑ + 8KOH;
②根据将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比i快的现象,得出pH越小,氧化性越强,
故答案为:pH越小,氧化性越强;
(3).①根据图像,pH≈8时,K2FeO4脱氮率最高,
故答案为:pH≈8;
②图像可以得出,pH = 4时,氮元素的去除率为百分之六十,生活垃圾渗透液的脱氮(将含氮物质转化为N2)生活垃圾中的含氮物质为NH4+,
故答案为:NH4+;
③由于pH越小,高铁酸钾的氧化性越强,则PH增大,会使高铁酸钾的氧化性减弱,
故答案为:pH>8的溶液,随pH增大,K2FeO4氧化性碱弱,不利于将含氮物质氧化;

 。
。 C+MgO
C+MgO  MgO+H2O
MgO+H2O  2MgO
2MgO MgCl2
MgCl2  MgS
MgS Mg3N2
Mg3N2  Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq) Mg+Cl2↑
Mg+Cl2↑