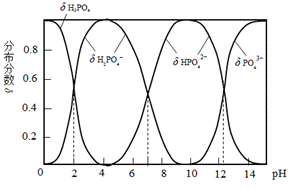
磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如图,下列说法正确的是( )
A. H3PO4的电离方程式为:H3PO4![]() 3H++ PO43−
3H++ PO43−
B. pH=2时,溶液中大量存在的微粒有:H3PO4、H2PO4−、HPO42−、PO43−
C. 滴加NaOH溶液至pH=7,溶液中c(Na+)= c(H2PO4−)+2c(HPO42−)+3c(PO43−)
D. 滴加少量Na2CO3溶液,3Na2CO3+2H3PO4 =2Na3PO4+3H2O+3CO2↑
答案
【答案】C
【解析】
【分析】
观察图可知:随着PH值的增大,水溶液中各种含磷微粒的含量相应的发生改变:PH从0到4,H3PO4含量下降,H2PO4-含量上升,PH=2时,两者浓度相等,其它含磷微粒含量几乎为零;从4到10,H2PO4-含量下降,HPO42-含量上升,PH=7时,两者浓度相等,其它含磷微粒含量几乎为零;pH>10,HPO42-含量下降,PO43-含量上升,PH在虚线所标处两者浓度相等,其它含磷微粒含量几乎为零。根据图中各微粒的分布情况,结合弱电解质的电离,电中性原则及物质的基本性质可对各选项作出判断。
【详解】A项、磷酸是三元中强酸,属于弱电解质,电离方程式应分步书写,A选项错误;
B项、由图可知,PH=2时,含磷微粒主要是H3PO4和H2PO4-,其它含量几乎为零,B错;
C项、根据电中性原则有:c(H+)+c(Na+)= c(H2PO4−)+2c(HPO42−)+3c(PO43−)+c(OH-),PH=7时,c(H+)=C(OH-),所以有:c(Na+)= c(H2PO4−)+2c(HPO42−)+3c(PO43−),C正确;
D项、生成二氧化碳的环境为酸性环境,在磷酸中滴加少量碳酸钠溶液得到的含磷产物主要是H2PO4-或HPO42-,D错;
答案选C![]()
【点睛】本题中,要结合图来判断不同环境下的含磷微粒的存在形式。如D选项,要根据反应的量来判断反应后的溶液酸碱性,从而判断微粒的存在形式。

 NH4++NH2-,由于液氨的自偶电离程度比水要弱,所以是非电解质。
NH4++NH2-,由于液氨的自偶电离程度比水要弱,所以是非电解质。