乙醇结构式如图所示,“箭头”表示乙醇发生化学反应时分子中可能断键的位置,下列叙述中不正确的是( )
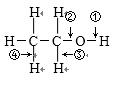
A. 与钠反应时断裂①键 B. 发生消去反应时断裂②④键
C. 与乙酸发生酯化反应时断裂②键 D. 发生催化氧化反应时断裂①③键
答案
【答案】C
【解析】
【分析】
A、根据乙醇与与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键;
B、乙醇和浓H2SO4共热至170℃时发生消去反应,断裂碳氧键、与羟基所连的碳的相邻的碳上的碳氢键;
C、乙醇与羧酸发生酯化反应时,醇脱氢、羧酸脱羟基;
D、乙醇在铜催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢。
【详解】A项、乙醇与与金属钠反应生成乙醇钠和氢气,反应的化学方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,由方程式可知乙醇断键的位置为①,故A正确;
B项、乙醇和浓H2SO4共热至170℃时,发生消去反应生成乙烯和水,反应的化学方程式为CH3CH2OH![]() CH2═CH2↑+H2O,由方程式可知乙醇断键的位置为②④,故B正确;
CH2═CH2↑+H2O,由方程式可知乙醇断键的位置为②④,故B正确;
C项、在浓硫酸作用下,乙醇和CH3COOH共热发生酯化反应生成乙酸乙酯和水,可以用18O标记乙醇,研究反应机理,反应的化学方程式为CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O,由方程式可知乙醇断键的位置为①,故C错误;
CH3CO18OCH2CH3+H2O,由方程式可知乙醇断键的位置为①,故C错误;
D项、在Cu或Ag做催化剂时,乙醇与O2共热反应生成乙醛和水,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,由方程式可知乙醇断键的位置为①和③,故D正确。
2CH3CHO+2H2O,由方程式可知乙醇断键的位置为①和③,故D正确。
故选C。
【点睛】本题主要考查乙醇的化学性质,注意掌握反应机理,明确官能团的变化是解题的关键。


 2CO2+3H2O
2CO2+3H2O  )就不能发生消去反应。能发生消去反应的醇的结构特点为:
)就不能发生消去反应。能发生消去反应的醇的结构特点为:



 作为示踪原子来确定反应机理。如:
作为示踪原子来确定反应机理。如: