铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
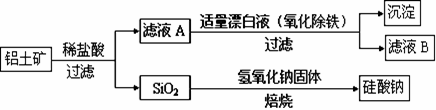
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:_______________(注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边___________________(填![]() 操作名称)、过滤、洗涤。
操作名称)、过滤、洗涤。
④高铁酸钠(Na2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与漂白液(主要成分NaClO)在强碱性条件下反应可制取Na 2FeO4,反应的离子方程式为___________________________。
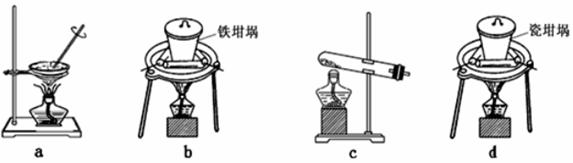
(2) ①SiO2和NaOH焙烧制备硅酸钠,可采用的装置为_______________(填代号)。
②过量CO2通入到硅酸钠的溶液中,然后加热蒸干,再高温灼烧,最后所得固体成分___________。
答案
【答案】取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B 中不含铁元素c蒸发浓缩、冷却结晶2Fe3++3ClO-+10 OH-=2FeO42—+3Cl-+5H2O (或2Fe(OH)3+3ClO-+4OH-=2FeO42—+3Cl-+5H2O)b硅酸钠
【解析】 (1). ①.检验滤液B中是否还含有铁元素的方法为利用铁离子和亚铁离子的检验方法进行检验,具体操作为取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素,故答案为:取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素;
②.滤液B中含有的是氯化铝,将滤液B中的铝元素以沉淀形式析出,
a.氢氧化钠溶液可以沉淀铝离子但过量的氢氧化钠会溶解氢氧化铝,氢氧化钠不是最佳试剂,故a不选;
b.硫酸溶液不与铝离子反应,故b不选;
c.氨水是弱碱不能溶解氢氧化铝,过量的氨水和铝离子形成氢氧化铝沉淀过滤得到氢氧化铝固体,故c选;
d.二氧化碳和氯化铝不反应,无法生成氢氧化铝沉淀,故d不选,答案为:c;
③.加入浓盐酸可抑制氯化铝的水解,经蒸发浓缩、冷却结晶,过滤,洗涤得氯化铝晶体,故答案为:蒸发浓缩、冷却结晶;
④. FeCl3与漂白液(主要成分NaClO)在强碱性条件下反应可制取Na 2FeO4的离子方程式为2Fe3++3ClO-+10OH-=2FeO42—+3Cl-+5H2O (或2Fe(OH)3+3ClO-+4OH-=2FeO42—+3Cl-+5H2O),故答案为:2Fe3++3ClO-+10OH-=2FeO42—+3Cl-+5H2O (或2Fe(OH)3+3ClO-+4OH-=2FeO42—+3Cl-+5H2O);
(2). ①.a. 蒸发皿中含有二氧化硅,可与NaOH反应,不能用于SiO2和NaOH焙烧制备硅酸钠,故a错误;
b. 铁坩埚可以熔融二氧化硅和氢氧化钠,可在铁坩埚中用SiO2和NaOH焙烧制备硅酸钠,故b正确;
c. 玻璃试管中含二氧化硅,可与氢氧化钠反应,不能用于SiO2和NaOH焙烧制备硅酸钠,故c错误;
d. 瓷坩埚中含有二氧化硅,可与氢氧化钠反应,不能用于SiO2和NaOH焙烧制备硅酸钠,故d错误,答案选b;
②. 过量CO2通入到硅酸钠的溶液中,反应生成硅酸沉淀和碳酸氢钠,然后加热蒸干,再高温灼烧,碳酸氢钠分解生成碳酸钠、硅酸分解生成二氧化硅,二氧化硅和碳酸钠在高温下反应生成硅酸钠和二氧化碳,最后所得固体成分为硅酸钠,故答案为:硅酸钠。