在有机化学中,硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =−97.3 kJ·mol−1,实验装置如图所示(部分夹持装置未画出)。
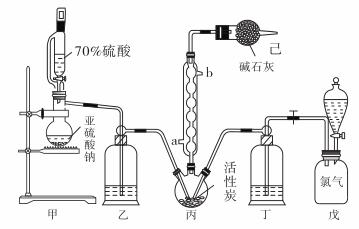
已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置丙中作为反应容器的仪器的名称为_______,装置丙中球形冷凝管的作用是________;如何控制两种反应物体积相等:____________________________________。
(2)装置戊上方分液漏斗中最好选用下列试剂:_________________(选填字母)
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 mol·L-1盐酸
(3)若缺少装置己,硫酰氯(SO2Cl2)会和空气中的水反应而变质,其化学方程式是_____________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H![]() SO2Cl2 + H2SO4,分离两种产物的方法是_____________(选填字母)。
SO2Cl2 + H2SO4,分离两种产物的方法是_____________(选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是_________________________________(用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为___________。
(7)请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):___________________________。
答案
【答案】 三颈烧瓶 冷凝回流导气 观察乙、丁导管口产生气泡的速度相等 B SO2Cl2+2H2O==H2SO4+2HCl C SO2Cl2=SO2+Cl2,分解产生少量的氯气溶解在其中 75% 取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸
 给信息,进行如下操作:取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸。正确答案:取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸。
给信息,进行如下操作:取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸。正确答案:取产物在干燥的环境中加热至100℃,待产物的质量不在改变时,冷却后将剩余物质加入到水中;取少量溶液加入石蕊试液,溶液变红;再取少量试液加入氯化钡溶液,产生白色沉淀,则说明产品中有硫酸。


