向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中c(SO32-)/c(Fe3+)变化的曲线如图所示。实验发现:
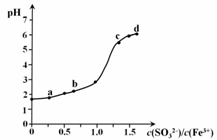
i. a点溶液透明澄清,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色;
ii. c点和d点溶液中产生红褐色沉淀,无气体逸出。取其上层清液滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色。下列分析合理的是
A. 向a点溶液中滴加BaCl2溶液,无明显现象
B. b点较a点溶液pH升高的主要原因:2Fe3+ + SO32- + H2O === 2Fe2+ + SO42- + 2H+
C. c点溶液中发生的主要反应:2Fe3+ + 3SO32- + 6H2O![]() 2Fe(OH)3↓+ 3H2SO3
2Fe(OH)3↓+ 3H2SO3
D. 向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深
答案
【答案】C
【解析】A.由以上分析得,向a点溶液中滴加BaCl2溶液,有硫酸钡白色沉淀产生,故A错误;B.若2Fe3++SO32-+H2O═2Fe2++SO42-+2H+,发生此反应,酸性加强,pH减小,故B错误;C.c点和d点溶液中产生红褐色沉淀,无气体逸出,故发生的反应为2Fe3++3SO32-+6H2O⇌2Fe( OH)3+3H2SO3,故C正确;D.d点发生的反应为2Fe3++3SO32-+6H2O⇌2Fe( OH)3↓+3H2SO3,这是一个可逆反应,反应物不能完全转化为生成物,故滴加KSCN溶液,溶液变红;滴加NaOH溶液,平衡向正反应方向移动,铁离子浓度减少,红色变浅,故D错误;故选C。

 ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。 

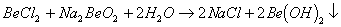 能完全进行,则下列推断中,正确的是
能完全进行,则下列推断中,正确的是 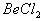 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO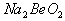 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO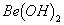 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液