25℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)物质的量浓度相等的CH3COONa溶液和NaClO溶液pH大小关系为:c(CH3COONa)_____c(NaClO)(填“>”、“<”或“=”)。
(2)H2CO3的电离方程式为:_____。
(3)向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式为:_____。
(4)泡沫灭火器内筒装有Al2(SO4)3溶液,外筒装有NaHCO3溶液。
① Al2(SO4)3溶液呈酸性的原因是:_____。(用离子方程式说明)
② 内、外筒溶液混合后发生反应离子方程式为:_____。
(5)常温下0.1 mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变大的是______。
A.c(H+) B.c(H+)·c(OH-)
C. ![]() D.
D.
(6)H+浓度相等、体积相等的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应后,仅有一份溶液中剩余锌,放出氢气的质量相同,则下列说法正确的是 __(填写序号)。
①开始反应时的速率A>B ②放出等量氢气所需要的时间B>A
③参加反应的锌的物质的量A=B ④A中有锌剩余
答案
【答案】 < H2CO3 ![]() HCO
HCO![]() +H+ HCO3-
+H+ HCO3- ![]() CO32- + H+ (或H2CO3
CO32- + H+ (或H2CO3 ![]() HCO
HCO![]() +H+) ClO- + CO2 + H2O = HCO3- + HclO Al3+ + 3H2O
+H+) ClO- + CO2 + H2O = HCO3- + HclO Al3+ + 3H2O ![]() Al(OH)3 + 3H+ Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑ C ③④
Al(OH)3 + 3H+ Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑ C ③④
【解析】(1)根据表中数据可以知道,酸的电离出平衡常数大小为:CH3COOH>H2CO3>HClO>HCO3-,电离平衡常数越大,酸性越强,对应的盐水解越弱;
(2)H2CO3为二元弱酸,分两步电离,以第一步为主,电离方程式为:H2CO3 ![]() HCO
HCO![]() +H+ HCO3-
+H+ HCO3- ![]() CO32- + H+ ;
CO32- + H+ ;
(3)因为酸性H2CO3>HClO>HCO3-,根据强制弱规律,向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式为:ClO- + CO2 + H2O = HCO3- + HClO ;
(4)① Al2(SO4)3溶液中由于Al3+水解而呈酸性。
② Al2(SO4)3溶液和NaHCO3溶液混合,发生相互促进水解;
(5)A.0.1 mol•L-1的CH3COOH溶液加稀释过程中,溶液中氢离子浓度减小;
B、KW=c(H+)·c(OH-)只受温度的影响,温度不变则其值是一个常数;
C.0.1 mol•L-1的CH3COOH溶液加稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,所以![]() 增大;
增大;
D.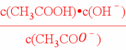 =Kw/Ka,为常数,因为温度不变则常数不变;
=Kw/Ka,为常数,因为温度不变则常数不变;
(6)由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余,以此解答该题。
详解:(1)根据表中数据可以知道,酸的电离出平衡常数大小
为:CH3COOH>H2CO3>HClO>HCO3-,电离平衡常数越大,酸性越强,对应的盐水解越弱,所以pH大小关系为:c(CH3COONa)<c(NaClO),
因此,本题正确答案是:<;
(2)H2CO3为二元弱酸,分两步电离,以第一步为主,电离方程式为:H2CO3 ![]() HCO
HCO![]() +H+ , HCO3-
+H+ , HCO3- ![]()


 NH4++NH2-,由于液氨的自偶电离程度比水要弱,所以是非电解质。
NH4++NH2-,由于液氨的自偶电离程度比水要弱,所以是非电解质。