I.(1)利用水蒸气或二氧化碳对甲烷进行重整是提高甲烷利用率的重要方式水蒸气重整:
CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H1=+205.9 KJ·mol-1 ①
CO(g)+3H2(g) △H1=+205.9 KJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H 2 =-41.2 KJ·mol-1 ②
CO2(g)+H2(g) △H 2 =-41.2 KJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H 3 ③
2CO(g)+2H2(g) △H 3 ③
则反应①自发进行的条件是____________,△H3 =___________KJ·mol-1![]()
Ⅱ.2017年7月10日我国甲烷、二氧化碳重整制合成气装置在山西实现全系统运行,减少了温室气体的排放。
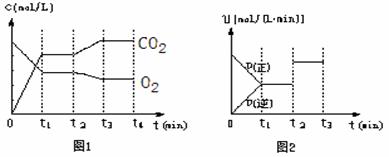
(2)某2L恒容密闭容器中,投入2 mol CH4和2 mol CO2,不同温度下平衡体系中CH4和CO的物质的量分数![]() /(y)%随温度变化如右图所示:
/(y)%随温度变化如右图所示:![]()

①T1温度下该反应的平衡常数是_________
②2c点CH4的物质的量分数为_________
③v逆:a_________b点(填“>”、“<”、“=”、“无法确定”),理由是________![]() 。
。
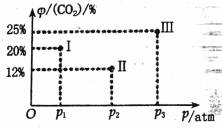
(3)现有温度相同的I、II、III三个恒压密闭容器,均已充入1 mol CH4(g)和1 mol CO2(g),三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的的情况下,反应进行到tmin时,CO2的体积分数如下图,此时I、II、III三个容器中可能处于化学平衡状态的是_________![]() 。
。
III.(4)以多孔石墨为阳极,以NaCl和NaOH的混合溶液作电解液,用电解法由甲烷制取甲醇。写出阳极的电极反应式:________________。
答案
【答案】 高![]() 温 +247.1
温 +247.1 ![]() mol2/L2 10% < 与a点相比,b点温度更高且CO、H2浓度更大 III CH4+2OH--2e-=CH3OH+H2 O
mol2/L2 10% < 与a点相比,b点温度更高且CO、H2浓度更大 III CH4+2OH--2e-=CH3OH+H2 O
【解析】I.(1) 反应①CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H1=+205.9 KJ·mol-1自发进行,则△G=△H-T△S <0,反应为熵增焓增的反应,则高温条件有利于自发进行;已知①CH4 (g)+H2O(g)
CO(g)+3H2(g) △H1=+205.9 KJ·mol-1自发进行,则△G=△H-T△S <0,反应为熵增焓增的反应,则高温条件有利于自发进行;已知①CH4 (g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g) 


 ,
, ,所以
,所以