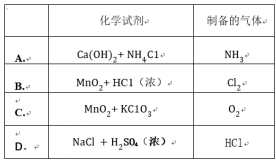
氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572kJ·mol-1。请回答下列问题:
(1)生成物能量总和_____(填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量______(填“大于”“小于”或“等于”)572kJ。
(3)H2的标准燃烧热ΔH=_____。
(4)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
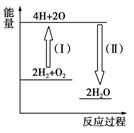
已知拆开1molH2、1molO2和1 mol H—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)_____(填“吸收”或“放出”)_____kJ。
答案
【答案】 (1). 小于 (2). 小于 (3). -286 kJ·mol-1 (4). 放出 (5). 1852
【解析】
【分析】
(1)反应是放热反应,所以反应物的总能量高于生成物的总能量;(2)气态水的能量高于液态水的能量,所以氢气燃烧生成气态水放出的能量低;(4)根据图像可知,反应过程(Ⅱ)是形成化学键的,是放热过程,放出的热量是2×2×463kJ=1852kJ。
【详解】(1)该反应的ΔH<0,为放热反应,生成物能量总和小于反应物能量总和。
(2)由热化学方程式可知,2 mol氢气燃烧生成液态水,放出572 kJ热量,由于液态水变为水蒸气需要吸收热量,故2 mol氢气燃烧生成水蒸气,放出的热量小于572 kJ。
(3)标准燃烧热ΔH=-![]() kJ·mol-1,=-286 kJ·mol-1。
kJ·mol-1,=-286 kJ·mol-1。
(4)反应过程(1)中,能量由低到高,反应吸收热量,反应过程(Ⅱ)中,能量由高到低,反应放出热量。反应过程(Ⅱ)中形成了4 mol H—O键,放出的热量为:4×463 kJ=1852 kJ。
【点睛】本题考查化学反应与能量变化,明确热化学方程式的意义和反应热与键能的关系是解题的关键,题目难度中等。