为将含有的FeCl3、FeCl2、CuCl2的废液中的Cu2+还原回收,某同学在含有ag铁粉的容器中加入废液,探究了加入废液体积与完全反应后体系中固体质量的关系,部分实验数据如下表所示。已知:废液中c(Cu2+)=0.7 mol·Lˉ1;废液体积大于0.5L,充分反应后才能检测出Cu2+。
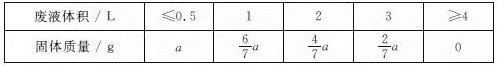
下列说法不正确的是
A. 当铁粉与0.25L废液反应完全后,固体成分为Fe与Cu
B. 当铁粉与1L废液反应完全后,再加入废液时发生的离子反应为Fe +2Fe3+=3Fe2+
C. 废液中c(Fe3+)=0.2 mol·Lˉ1
D. 要将1L废液中的Cu2+全部还原,则至少需要铁粉44.8g
答案
【答案】B
【解析】
【分析】
由题给数据可知,当废液体积≤0.5L时,固体质量不变,说明溶液中发生反应2Fe3++Fe=3Fe2+,Fe+Cu2+=Cu+Fe2+,且Fe3+消耗Fe的质量等于Cu2+与Fe反应固体增加的质量,设溶液体积为VL,则有56g/mol×Vc(Fe3+)/2=0.7V×8,解得c(Fe3+)=0.2 mol/L;当废液体积大于等于4L时,固体质量为0,说明ag铁粉只与Fe3+反应,则ag铁粉物质的量为(0.2mol/L×4L)×1/2=0.4mol,a=(0.2mol/L×4L)×1/2×56g/mol=22.4g。
【详解】A项、由题给数据可知,当废液体积为0.25L废液时,固体质量不变,说明溶液中发生反应2Fe3++Fe=3Fe2+,Fe+Cu2+=Cu+Fe2+,则所得固体为Fe与Cu,故A正确;
B项、1L废液中n(Fe3+)为0.2mol、n(Cu2+)为0.7mol,Fe3+完全反应消耗0.1molFe,余下0.3 molFe与Cu2+完全反应,得到固体为Cu,再加入废液时,Cu与废液中Fe3+反应,反应的离子方程式为2 Fe3++Cu=2 Fe2++ Cu2+,故B错误;
C项、废液中c(Fe3+)=0.2 mol/L,故C正确;
D项、1L废液中n(Fe3+)为0.2mol、n(Cu2+)为0.7mol,Fe3+完全反应消耗0.1molFe,Cu2+完全反应消耗0.7molFe,共消耗0.8molFe,质量为44.8g,故D正确。
故选B。
【点睛】本题考查混合溶液中的计算,注意分析反应物的相对用量,正确判断随着废液体积增大,固体成分的变化是解答关键。