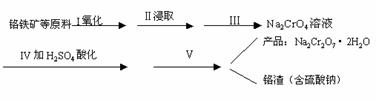
研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为 。
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为 。
(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
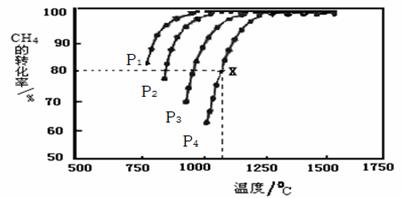
①工业生产时一般会选用P4和1250℃进行合成,请解释其原因 。
②在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为 ,该温度下,反应的平衡常数为 (保留3位有效数字)。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) ![]() CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取
①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是 。
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.气体平均相对分子质量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向 (填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为 。
答案
(1)大于800K(2分,漏答“大于”不给分)
(2)① 较大的压强和温度能加快合成速率,提高生产效率(2分,若答提高甲烷的转化率等不给分)
②0.032mol·L-1·min-1(2分) 1.64(2分)
(3)① ACD(2分, 漏选一个扣1分,错选0分)
②逆(2分) 12 g/mol (2分)


 ,
, ,所以
,所以