导电性实验可以作为研究电解质电离本质及反应机理的有效方法。
(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质A可以是____(填序号)。
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液 ⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
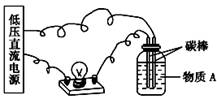 |
(2)在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是____。
A.盐酸中逐滴加入食盐溶液B.硫酸中逐滴加入氢氧化钠溶液
C.硫酸中逐滴加入氢氧化钡溶液
答案
.(1) ⑤⑥⑦⑧ (2) C
解析:CuCl2溶液与NaOH溶液混合,会生成蓝色沉淀,离子反应是Cu2++2OH-===Cu(OH)2↓;向NaHCO3溶液中滴加稀硫酸,会产生无色无味的气体,离子反应是HCO![]() +H+===CO2↑+H2O;稀硝酸和KOH溶液混合,会发生中和反应,离子反应是H++OH-===H2O。这三个反应均是复分解反应,但条件不同:第一个生成沉淀,第二个生成气体和水,第三个生成水;相同点是都使溶液中的离子浓度减小。
+H+===CO2↑+H2O;稀硝酸和KOH溶液混合,会发生中和反应,离子反应是H++OH-===H2O。这三个反应均是复分解反应,但条件不同:第一个生成沉淀,第二个生成气体和水,第三个生成水;相同点是都使溶液中的离子浓度减小。

 ”表示。
”表示。 

 溶液的pH>1,则证明
溶液的pH>1,则证明 是弱电解质。
是弱电解质。  溶液呈碱性,则证明醋酸是弱电解质。
溶液呈碱性,则证明醋酸是弱电解质。