废水中氨氮(主要以NH4+和NH3形式存在)的去除常见的有生物脱氮法和电解法。
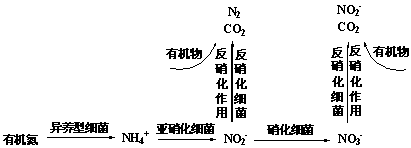 (1)生物脱氮法是将水中的氨氮通过硝化和反硝化作用最终转化为氮气而除去,其过程如下:
(1)生物脱氮法是将水中的氨氮通过硝化和反硝化作用最终转化为氮气而除去,其过程如下:
①硝化反应的适宜温度是15~20℃,温度过高,硝化速率会迅速下降,其可能原因是 ▲ 。
②请写出以有机物甲醇CH3OH对NO3-进行反硝化过程的离子反应方程式 ▲ 。
(2)电解法产生的强氧化性物质HClO也可将氨氮转化为氮气而除去,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟。
①阳极的电极反应式 ▲ ,处理1mol的(NH4)2SO4,需要消耗HClO的物质的量是
▲ mol。
 ②已知25℃氯水溶液中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如下图所示。
②已知25℃氯水溶液中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如下图所示。
由图可知该温度下HClO的电离常数值为 ▲ 。
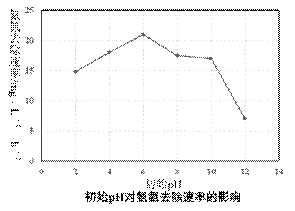
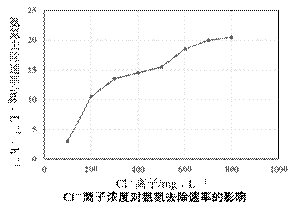 ③电解过程中溶液初始Cl-浓度和pH对氨氮去除速率影响关系如图甲和图乙所示。
③电解过程中溶液初始Cl-浓度和pH对氨氮去除速率影响关系如图甲和图乙所示。
甲 乙
图甲中发现随着Cl-浓度逐渐增大,氨氮的去除速率不断加快的原因可能是 ▲ 。
图乙中pH为6时处理效果最佳,当pH过低时,处理效果不佳的原因可能是 ▲ 。
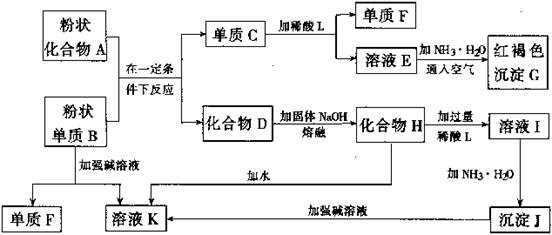
答案
反硝化细菌
(1)①温度高,硝化细菌失活或蛋白质变性 (2分)
②CH3OH+3NO3−![]() 3NO2−+CO2↑+2H2O (2分)
3NO2−+CO2↑+2H2O (2分)
(2)①2Cl-![]() 2e-
2e-![]() Cl2或H2O + Cl-
Cl2或H2O + Cl-![]() 2e-
2e-![]() HClO + H+ (2分) 3 (2分)
HClO + H+ (2分) 3 (2分)
②![]() (2分)
(2分)
③HClO浓度增大 (2分) pH小,抑制Cl2在水中的溶解,HClO浓度减小 (2分)

 。
。 C+MgO
C+MgO  MgO+H2O
MgO+H2O  2MgO
2MgO MgCl2
MgCl2  MgS
MgS Mg3N2
Mg3N2  Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq) Mg+Cl2↑
Mg+Cl2↑