.NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:
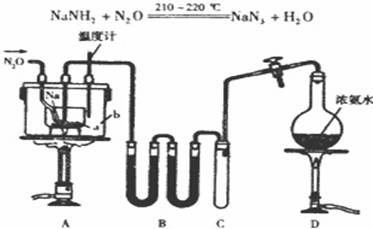
实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气.
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热D并关闭旋塞.
③向装置A中b容器内充入加热介质并加热到210一220℃,然后通入N2O.
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩、结晶.
⑤过滤,用乙醚洗涤,晾干.
已知:NaNH2熔点210℃,沸点400℃,在水溶液中易水解.
回答下列问题:
(1)图中仪器a用不锈钢材质而不用玻璃,其主要原因是___.
(2)装置B中盛放的药品为___;装置C的主要作用是___.
(3)步骤①先加热通氨气的目的是___;步骤②氨气与熔化的钠反应的方程式为___.
(4)步骤③b容器充入的介质为植物油,进行油浴而不用水浴的主要原因是___.
(5)生成NaN3的化学方程式为___.
(6)步骤⑤用乙醚洗涤的主要目的是___.
答案
【答案】反应过程中能生成NaOH腐蚀玻璃碱石灰或固体NaOH冷凝分离出水排尽装置中的空气2Na+2NH3=2NaNH2+H2↑水的沸点为100℃,不能达到反应控制的温度210-220℃,故用油浴加热NaNH2+N2O![]() NaN3+H2O减少晶体的损失,有利于产品迅速干燥。
NaN3+H2O减少晶体的损失,有利于产品迅速干燥。
【解析】(1)生成NaN3的化学方程式为:NaNH2+N2O![]() NaN3+H2O,反应过程中生成的水,又会与钠反应生成NaOH腐蚀玻璃,故答案为:反应过程中能生成NaOH腐蚀玻璃;
NaN3+H2O,反应过程中生成的水,又会与钠反应生成NaOH腐蚀玻璃,故答案为:反应过程中能生成NaOH腐蚀玻璃;
(2)制备的氨气中含有大量的水,用C装置盛放碱石灰干燥氨气, 用C装置冷凝分离出水,故答案为:碱石灰或固体NaOH、冷凝分离出水;
(3)步骤①先加热通氨气的目的是排尽装置中的空气。步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为:2Na+2NH3![]() 2NaNH2+H2
2NaNH2+H2![]() ,故答案为:排尽装置中的空气、2Na+2NH3=2NaNH2+H2↑;
,故答案为:排尽装置中的空气、2Na+2NH3=2NaNH2+H2↑;
(4)水的沸点为100℃,不能达到反应控制的温度210一220℃,故用油浴加热,故答案为:水的沸点为100℃,不能达到反应控制的温度210-220℃,故用油浴加热;
(5)反应物为N2O和NaNH2,生成物有NaN3,反应方程式为:NaNH2+N2O![]() NaN3+H2O;故答案为:NaNH2+N2O
NaN3+H2O;故答案为:NaNH2+N2O![]() NaN3+H2O;
NaN3+H2O;
(6)NaN3不溶于乙醚,用减少乙醚洗涤能减少晶体的损失,乙醚易挥发,有利于产品快速干燥。故答案为:减少晶体的损失,有利于产品迅速干燥。

 2H2O
2H2O  2CO2 CO2+Ca(OH)2=CaCO3↓+H2O
2CO2 CO2+Ca(OH)2=CaCO3↓+H2O  NH3?H2O
NH3?H2O NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl  CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O  2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br
2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br  4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2  的检验;
的检验;  的检验;
的检验;  苯酚的检验。
苯酚的检验。