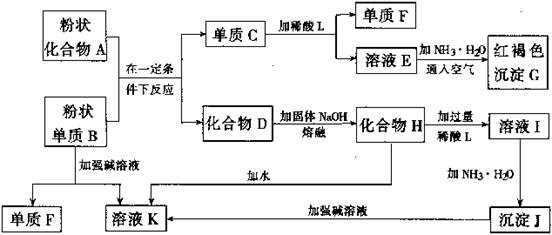
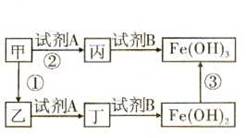
下图中,甲是氧化物,其中金属元素的质量分数为70%;乙是黑色粉末;丙和丁是可溶性盐。反应①和②的化学方程式分别为_____ 、_____;试剂B是_____ (填化学式)溶液;在氧气和水存在时能发生反应③,化学方程式为________ 。
答案
解析:本题属于信息推断题。首先根据题目所给信息可知甲是氧化物,其中金属元素的质量分数为70%,由图中已知两种物质的化学式可初步推断甲为铁的氧化物,而氧化铁中铁元素的质量分数刚好为70%,可确定甲为氧化铁。由题目可知乙为黑色粉末,而氧化铁被还原后生成的铁粉为黑色,可推知乙为铁。反应①为还原氧化铁的反应,可利用一氧化碳、碳或氢气还原。加入试剂A后,氧化铁和铁都会转化为可溶性盐,由此推断加入的试剂A为酸,可判断其为常见的稀盐酸或稀硫酸。由丙和丁中加入试剂B后转化成含有铁元素的两种碱,可推断加入的试剂B应为可溶性碱,常见的碱有氢氧化钠、氢氧化钙或氢氧化钾等。根据题给信息可书写反应③的化学方程式。
答案:Fe2O3+3CO![]() 2Fe+3CO2(或2 Fe2O3+3C
2Fe+3CO2(或2 Fe2O3+3C![]() 4Fe+3CO2↑等)
4Fe+3CO2↑等)
Fe2O3+6HCl=2FeCl3+3H2O[或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O等]
NaOH[或Ca(OH)2等] 4Fe(OH)2+O2+2H2O=4Fe(OH)3

 。
。 C+MgO
C+MgO  MgO+H2O
MgO+H2O  2MgO
2MgO MgCl2
MgCl2  MgS
MgS Mg3N2
Mg3N2  Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq) Mg+Cl2↑
Mg+Cl2↑