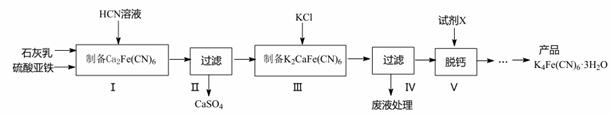
黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg•kgˉ1。一种制备黄血盐的工艺如下:
回答下列问题:
(1)步骤Ⅰ反应的化学方程式为 。
(2)步骤Ⅳ过滤所得的废液中含量较多的溶质为(填化学式) 。
(3)步骤Ⅴ所用的试剂 X 是 。
(4)工艺中用到剧毒的 HCN 溶液,含 CN -的废水必须处理后才能排放。已知氢氰酸是一种具有苦杏仁特殊气味的无色剧毒液体,易挥发,25℃时,Ka(HCN)=6.25×10 -10。
①NaCN 的电子式为 ,反应 CNˉ+H2O![]() HCN+OHˉ在 25℃时的平衡常数 K=
HCN+OHˉ在 25℃时的平衡常数 K=
________ (填数值)。
②处理含 CN-废水的方法是:第一步控制 pH>10,用NaClO溶液先将 CNˉ“不完全氧化”为 OCN-;第二步控制 pH 为 7.5~8.5,用NaClO“完全氧化” OCNˉ生成N2和两种盐。第一步控制强碱性的主要目的是 ,第二步反应的离子方程式为 。
答案
(1)6HCN+3Ca(OH)2+FeSO4=Ca2Fe(CN)6+CaSO4↓+6H2O (2分)
(2)Ca Cl2(KCl可答)(2分)
(3)K 2 CO 3 (2分)
(4) ①![]() (2分) 1.6×10-5(2分)
(2分) 1.6×10-5(2分)
②防止生产HCN,污染环境(2分)2CNO+3ClO+2H2O=N2![]() +3Cl+2HCO3-(2分)
+3Cl+2HCO3-(2分)