氟是一种卤族元素,但它与其他卤素在单质和化合物的制备与性质上存在较明显的差异。
(1)研究发现,SbF5能将MnF4从离子[MnF6]2-的盐中反应得到,SbF5转化成稳定离子[SbF6]-的盐。而MnF4很不稳定,受热易分解为MnF3和F2。根据以上研究写出以K2MnF6和SbF5为原料,在423 K的温度下制备F2的化学方程式:____________________。
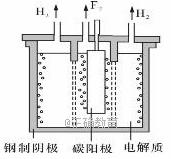 (2)现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
(2)现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
①已知KHF2是一种酸式盐,写出阴极上发生的电极反应式______________。
②电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是____________ 。
③已知25℃时,氢氟酸(HF)的电离平衡常数Ka=3.6×10-4。某pH=2的氢氟酸溶液,由水电离出的c(H+)=_________mol/L;若将0.01 mol/L HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度大小关系为:__________________。
④已知25℃时,溶度积常数Ksp(CaF2)=1.46×10-10。现向1L0.2 mol/L HF溶液中加入1L0.2 mol/L CaCl2溶液,____________(填“是”、“否”) 有沉淀产生,并通过列式计算说明__________________。
(3)已知 25℃时, Ksp[Fe(OH)3]=4.0×10-38,此温度下,若实验室中配制 2.5 mol/L 100 mLFe2(SO4)3溶液,为使配制过程中不出现浑浊,则至少需要加10 mol/L的硫酸______mL(忽略加入硫酸的体积)。
答案
(1)2K2MnF6+4SbF5![]() 4KSbF6+2MnF3+F2↑
4KSbF6+2MnF3+F2↑
(2)①2HF2-+2e-=H2↑+4F-
②氟气和氢气能发生剧烈反应,引发爆炸
③10-12c(Na+)>c(F-)>c(OH-)>c(H+)
④是 c(H+)=c(F-)=6×l0-3mol·L-1,c(Ca2+)=0.lmol·L-1,c(F-)2·c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10, 该体系有CaF2 沉淀
(3)0.25
