研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1) CO可用于炼铁,已知:
Fe2O3(s)+3C(s)![]() 2Fe(s)+3CO(g) ΔH 1=+489.0 kJ· mol-1
2Fe(s)+3CO(g) ΔH 1=+489.0 kJ· mol-1
C(s)+CO2(g)![]() 2CO(g) ΔH 2 =+172.5 kJ· mol-1
2CO(g) ΔH 2 =+172.5 kJ· mol-1
则CO还原Fe2O3(s)的热化学方程式
为 。
(2) 分离高炉煤气得到的CO与空气可设计成燃料电池,若电解质为碱性。写出该燃料电池的负
极反应式:
(3) 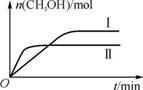 CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:
CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时
间的变化如右图。
①由右图判断该反应ΔH 0,曲线Ⅰ、Ⅱ对应的平衡常
数KⅠ KⅡ。(填“>”、“=”或“<”)
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达
到平衡。
| 容器 | 甲 | 乙 |
| 反应物 投入量 | 1 mol CO2、 3 mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相
等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是
(填字母)。
a. 容器中压强不变 b. H2的体积分数不变 c. c(H2)=3c(CH3OH) d. 容器中密度不变
e. 2个C![]() O键断裂的同时有3个C—H键形成
O键断裂的同时有3个C—H键形成
(4) 将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)。
CH3OCH3(g)+3H2O(g)。
二甲醚可用作直接燃料电池,1 mol二甲醚分子经过电化学氧化,可以产生 个电
子的电量;根据化学反应原理,分析增加压强对制备二甲醚反应的影
响: 。
答案
. (1) Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH=-28.5 kJ· mol-1
2Fe(s)+3CO2(g) ΔH=-28.5 kJ· mol-1
(2) CO+4OH-― 2e-![]() C+2H2O (3) ① < > ②0.4<c≤1 ③ab
C+2H2O (3) ① < > ②0.4<c≤1 ③ab
(4) 12NA 该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加,反应速率增
大
