硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业上普遍使用Na2SO3与硫黄共
煮制备Na2S2O3,装置如图1。 已知:Na2S2O3在酸性溶液中不能稳定存在。
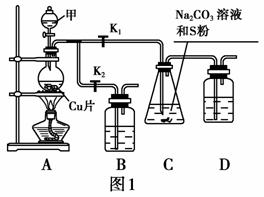
(1)步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量试剂甲并加热,则试剂甲为 ________。
步骤2:始终保持C中溶液呈碱性,反应一段时间后,硫粉的量逐渐减少,打开K2、关闭K1并
停止加热。必须保持C中溶液呈碱性的原因:若呈酸性,则 、
_(用离子方程式表示)。装置B、D的作用是________________。
步骤3:将C中所得混合物分离提纯后得产品。
(2)利用反应2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2也能制备Na2S2O3。所需仪器如图2。
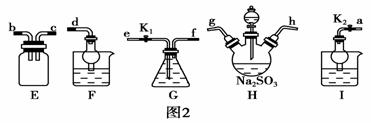
①按气流方向连接各仪器,接口顺序为:____→g,h→____,____→____,____→d。
②装置G盛装的试剂是______________。
(3)Na2S2O3还原性较强,工业上常用来除去溶液中残留的Cl2,该反应的离子方程式为____________________________________________________________________________
(4)请设计简单的实验方案,证明上述残留的Cl2被还原成了Cl-:______________ ______________________________________________________________________________________
答案
答案: (1)浓硫酸 CO![]() +2H+===H2O+CO2↑ S2O
+2H+===H2O+CO2↑ S2O![]() +2H+===SO2↑+S↓+H2O 吸收SO2,防止污染
+2H+===SO2↑+S↓+H2O 吸收SO2,防止污染
(2)①a b c e f ②Na2CO3和Na2S的混合溶液
(3)S2O![]() +4Cl2+5H2O===2SO
+4Cl2+5H2O===2SO![]() +8Cl-+10H+
+8Cl-+10H+
(4)取少量反应后的溶液于试管中,滴入Ba(NO3)2溶液至不再产生沉淀,再取上层清液(或过滤后取滤液),滴加AgNO3溶液,若产生白色沉淀,则说明Cl2被还原成了Cl-

 2H2O
2H2O  2CO2 CO2+Ca(OH)2=CaCO3↓+H2O
2CO2 CO2+Ca(OH)2=CaCO3↓+H2O  NH3?H2O
NH3?H2O NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl  CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O  2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br
2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br  4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2  的检验;
的检验;  的检验;
的检验;  苯酚的检验。
苯酚的检验。