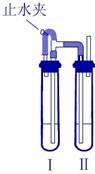
某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
(1)为快速得到乙醇气体,可采取的方法是_______;
若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是_________(填写编号);
a.取下小试管 b.移去酒精灯 c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中出现的现象为_____________________________。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。
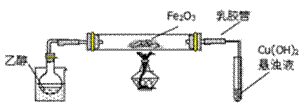
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有Fe2+和Fe3+,检验该溶液中的Fe2+的方法是_________;
关于M中铁元素价态的判断正确的是____(填写编号)。
a.一定有+3价和+2价铁,无0价铁
b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,无+2价铁
d.一定有+3和+2价铁,可能有0价铁
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置和步骤如下:
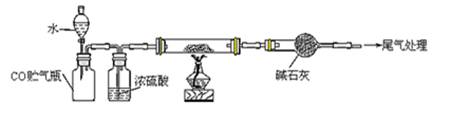
①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是__________(填写编号)
a.①⑤④③②⑥⑦⑧ b.①③⑤④②⑦⑥⑧ c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中![]() =_____。
=_____。
答案
【答案】 (1). 在烧杯中加入热水(对烧杯加热) (2). c (3). 试管中出现砖红色沉淀 (4). 在Fe2+和Fe3+溶液中检验Fe2+的方法是:取少量溶液于试管中,加入酸性高锰酸钾溶液,若紫红色褪去,则说明有Fe2+(或向溶液中加入K3,若产生蓝色沉淀,则说明有Fe2+) (5). d (6). c (7). ![]()
【解析】试题分析:(1) 快速得到乙醇气体,可采取的方法是在烧杯中加入80℃的热水给烧瓶加热(或烧杯热水并加热),若实验时小试管中的溶液已经开始发生倒吸,应采取的措施是将导管从乳胶管中取下;(2)盛Cu(OH)2悬浊液的试管中出现砖红色沉淀。
(3)在取少量溶液于试管中,加入酸性高锰酸钾溶液,若紫红色褪去,则说明有Fe2+(或向溶液中加入K3,若产生蓝色沉淀,则说明有Fe2+)。M能被磁铁吸引,说明可能是单质Fe或Fe3O4,加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成,不可能全部为Fe,证明一定含有Fe3O4,稀硫酸溶解得到Fe2+和Fe3+溶液,若有少量的Fe单质,能与Fe3+反应生成Fe2+,故选d;(5)M样品质量ag与CO减小b g,减小的是O的质量,余下的是Fe的质量,则FexOy中=![]() =
=![]() 。
。
考点:化学实验的设计与评价。