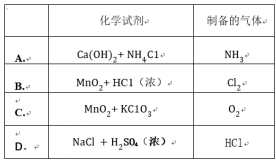
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是( )
A.煤的形成 B.鞭炮燃放
C.简单机械织布 D.我国古代烧制陶器
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。
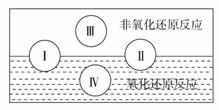
试写出有水参加的符合反应类型Ⅳ的一个离子反应方程式:__________________________________,其中水为_____________剂。
(3)氯化铵常用于焊接。如在焊接铜器时用过量的浓氯化铵溶液除去铜器表面的氧化铜以便焊接,其反应为: ___CuO+____NH4Cl![]() ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式。(配平时系数为“1”必须写出)
②该反应中,被氧化的元素是_______(填元素名称),氧化剂是________(填化学式)。
(4)工业制CuSO4时,不是直接用铜跟浓硫酸在加热条件下反应,而是将铜丝浸入稀硫酸中,再不断由容器下部吹入细小的热空气泡。
①写出所发生反应的化学方程式_______________________________________
②这样做的好处是①______________________②______________________
(5)K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,当有14.6gHCl被氧化时,电子转移的数目为_____________。
答案
(1)C(1分)
(2)2Na+2H2O=2Na++OH-+H2↑(2分)水做氧化剂(1分)
(其他含水的置换反应均可)
(3)①4CuO+2NH4Cl![]() 3Cu+ 1 CuCl2+ 1 N2↑+4H2O (3分)
3Cu+ 1 CuCl2+ 1 N2↑+4H2O (3分)
②氮 (1分) CuO(1分)
(4) 2Cu + O2+ 2H2SO4 ![]() 2CuSO4+2H2O(2分)(分步写也可)
2CuSO4+2H2O(2分)(分步写也可)
①节省硫酸的用量(1分) ② 不会产生对大气污染的SO2(1分)
(5)2.408×1023(2分)