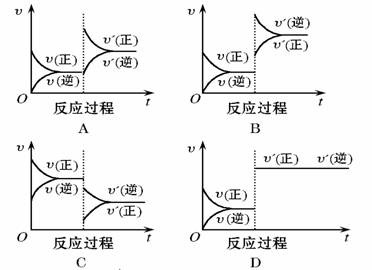
Ⅰ.在一定条件下,反应A(g)+2B(s) ![]() C(g)(正反应为吸热反应)达到平衡后,根据下列图像判断:
C(g)(正反应为吸热反应)达到平衡后,根据下列图像判断:
 |
(1)增大压强,达到新平衡的是 (填图像对应的序号,下同)。A的转化率(填“增大”、“减小”、“不变”,下同)。 。
(2)增大A的量,达到新平衡的是 ,此时A的转化率 。
Ⅱ. 工业合成氨N2(g)+3H2(g)![]() 2NH3(g)反应过程中的能量变化如下图所示,据图回答
2NH3(g)反应过程中的能量变化如下图所示,据图回答![]() 下列问题:
下列问题:
![]()
![]()
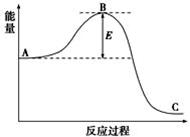
(![]() 1)该反应通常用活性铁作催化剂,加活性铁会使图中B点(填“升高”还是“降低”) ,理由是 。
1)该反应通常用活性铁作催化剂,加活性铁会使图中B点(填“升高”还是“降低”) ,理由是 。
(2)该反应平衡常数表达式为:K= ,增大氮气的量,K (填“增大”、“减小”、“不变”,下同)。
(3)一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的合理措施有 (填字母代号)。
a.高压 b.加入催化剂 c.增加N2的浓度 d.增加H2的浓度 e.分离出NH3
Ⅲ. 在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应为 反应。(填“吸热”或“放热”)
(2)830℃,固定容器为2L的密闭容器中,放入混合物,其始浓度为c(CO) =0.1mol/L, c(H2O) =0.3mol/L,经3s后达到平衡;则平衡时CO的物质的量为 ;3s内CO2的平均反应速率为 。
(3)可以判断已知的可逆反应达到平衡状态的是 (填字母代号)。
a.容器内的压强不再变化
b.单位时间内生成amolCO2同时消耗amolCO
c.容器内生成的CO浓度与H2浓度相等
d.单位时间内生成amolCO2同时生成2amolCO
e.单位时间内生成amolCO2同时生成amolH2
答案
a (1) D; 不变 (各1分) (2) A; 减小 (各1分)
b(1)降低;催化剂能降低反应的活化能 (各1分)
(2) ![]() (2分) ; 不变(1分) (3) a d e(2分)
(2分) ; 不变(1分) (3) a d e(2分)
C (1)吸热 (1分) (2) 3/10 mol 1/10 mol/(L.S) (各3分) (3) e(2分)
