氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g) ![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O ![]() HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO ![]() H+ + ClO- Ka=?
H+ + ClO- Ka=?
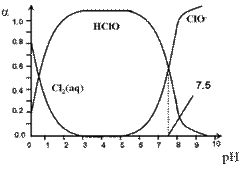
其中,Cl2(aq)、HClO和ClO-分别在三者中所占的物质的量分数(α)随pH变化的关系如图所示。下列表述正确的是
A.Cl2(g)+ H2O ![]() 2H+ + ClO- + Cl- K=10-10.9
2H+ + ClO- + Cl- K=10-10.9
B.pH=7.5时,用氯处理饮用水体系中,c(Cl-) + c(HClO) =c(H+)-c(OH-)
C.用氯处理饮用水时,pH=6.5时杀菌效果比pH=4.5时好
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
答案
【答案】B
【解析】
试题分析:A.由于HClO是弱酸,所以氯气与水反应的离子方程式是Cl2(g)+ H2O ![]() H++HClO+Cl-,错误;B. 在pH=7.5时,溶液中含有的Cl元素的微粒是HClO、ClO-,在纯水中存在水的电离平衡:H2O
H++HClO+Cl-,错误;B. 在pH=7.5时,溶液中含有的Cl元素的微粒是HClO、ClO-,在纯水中存在水的电离平衡:H2O![]() H++OH-;而在氯气处理的水中溶液中的H+包括水电离的和酸电离产生的两部分,酸电离产生的H+包括盐酸和次氯酸两种电离产生;所以c(Cl-) + c(OH-) =c(H+)-c(HClO),所以c(Cl-) + c(HClO) =c(H+)-c(OH-),正确;C.由于HClO的杀菌能力比ClO-强,在溶液的pH=4.5时酸性比pH=6.5时要强,HClO浓度大,所以用氯处理饮用水时,pH=6.5时杀菌效果比pH=4.5时差,错误; D.HClO不稳定,光照容易分解,所以氯处理饮用水时,在夏季的杀菌效果比在冬季差,错误。
H++OH-;而在氯气处理的水中溶液中的H+包括水电离的和酸电离产生的两部分,酸电离产生的H+包括盐酸和次氯酸两种电离产生;所以c(Cl-) + c(OH-) =c(H+)-c(HClO),所以c(Cl-) + c(HClO) =c(H+)-c(OH-),正确;C.由于HClO的杀菌能力比ClO-强,在溶液的pH=4.5时酸性比pH=6.5时要强,HClO浓度大,所以用氯处理饮用水时,pH=6.5时杀菌效果比pH=4.5时差,错误; D.HClO不稳定,光照容易分解,所以氯处理饮用水时,在夏季的杀菌效果比在冬季差,错误。
考点:考查氯气与水反应体系中各种离子浓度关系及水处理效果优劣评价的知识。

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L