碱式碳酸钴[Cox(OH)y(C03)z]常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置进行实验。
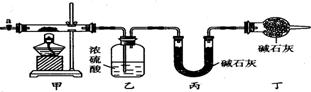
(1)请完成下列实验步骤:
①称取3.65 g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并 .
③加热甲中玻璃管,当乙装置中 (填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是 o
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的 (填字母)连接在 (填装置连接位置)。
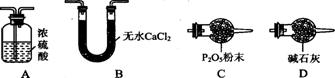
(4)若按正确装置进行实验,测得如下数据。
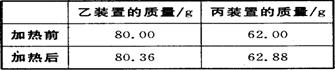
则该碱式碳酸钴的化学式为 。
(5)含有Co(A102)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为 。
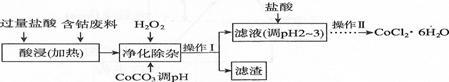
(6)CoCl2·6H2O常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
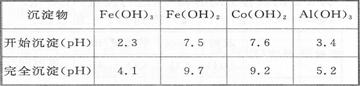
已知:25℃时,Ksp[Fe(OH)3]=2.79X10-39
①净化除杂时,加入H2O2发生反应的离子方程式为
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为 。
③已知:Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq)ΔH=akJ/mol
Fe3+(aq)+3OH-(aq)ΔH=akJ/mol
H2O(l)=H+(aq)+OH-(aq)ΔH=b kJ/mol
请写出Fe3+发生水解反应的热化学方程式: .
水解平衡常数Kh= .
④加盐酸调整pH为2~3的目的为 。
⑤操作Ⅱ过程为蒸发浓缩、 (填操作名称)、过滤。
(7)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料C6中(如图所示)。
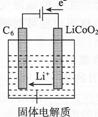
电池反应为LiCoO2+C6![]() CoO2+LiC6,写出该电池放电时的正极反应式: 。
CoO2+LiC6,写出该电池放电时的正极反应式: 。
答案
【答案】(1)②检查装置的气密性③不再有气泡产生时
(2)将装置中生成的CO2和H2O(g)全部排入乙、丙装置中
(3)D 活塞a前(或装置甲前)
(4)Co3(OH)4(CO3)2
(5)蓝色
(6)①2Fe2+(aq)+H2O2+ 2 H+=2Fe3++2H2O ②Al(0H)3、Fe(0H)3
③Fe3+(aq)+3H2O(l)![]() Fe(OH)3(s)+ 3 H+(aq) ΔH=(3b-a) kJ/mol 10-3/2.79 (2分)
Fe(OH)3(s)+ 3 H+(aq) ΔH=(3b-a) kJ/mol 10-3/2.79 (2分)
④抑制CoC12的水解 ⑤冷却结晶
(7)CoO2+Li++e-= LiCoO2
【解析】
试题分析:(1)②装置连接好后,应先检查装置的气密性;③当乙装置中不再产生气体时,说明反应完全,停止加热;
(2)根据题意该物质分解产生三种氧化物,其中有水蒸气和二氧化碳,所以步骤④中缓缓通入空气数分钟的目的是将装置中生成的CO2和H2O(g)全部排入乙、丙装置中,使计算结果准确;
(3)该实验是利用产生的水蒸气和二氧化碳的质量减少其组成,而甲装置前无除去空气中二氧化碳和水蒸气的装置,所以应在甲之前加一装置,除去空气中的二氧化碳和水,与丁装置相同,所以选择D;
(4)根据表中数据生成水蒸气的质量是0.36g,物质的量是0.36g/18g/mol=0.02mol,氢氧根离子的物质的量是0.04mol;生成二氧化碳的质量是0.88g,物质的量是0.88g/44g/mol=0.02mol,碳酸根离子的物质的量是0.02mol;则3.65g固体中钴的物质的量是[3.65g-(0.02mol×2×17g/mol+0.02mol×60g/mol)]/59g/mol=0.03mol,所以化学式中Co、OH-、CO32-的物质的量之比为0.03:0.02×2:0.02=3:4:2,所以该碱式碳酸钴的化学式为Co3(OH)4(CO3)2;
(5)实验室常用透过蓝色钴玻璃片观察钾元素的焰色反应的颜色,所以含有Co(A102)2的玻璃的颜色为蓝色;
(6)①加入过氧化氢的目的是将亚铁离子氧化为铁离子,所以离子方程式为2Fe2+(aq)+H2O2+ 2 H+=2Fe3++2H2O;
②加入CoCO3调pH为5.2~7.6,此时铁离子、铝离子完全沉淀,而钴离子开始沉淀,所以操作I得到滤渣的成分是Al(0H)3、Fe(0H)3;
③铁离子水解的离子方程式为:Fe3+(aq)+3H2O(l)![]() Fe(OH)3(s)+ 3 H+(aq),根据盖斯定律,将已知第一个热化学方程式减去第二个热化学方程式乘以3后所得热化学方程式的逆反应即为Fe3+发生水解反应的热化学方程式,所以答案为Fe3+(aq)+3H2O(l)
Fe(OH)3(s)+ 3 H+(aq),根据盖斯定律,将已知第一个热化学方程式减去第二个热化学方程式乘以3后所得热化学方程式的逆反应即为Fe3+发生水解反应的热化学方程式,所以答案为Fe3+(aq)+3H2O(l)![]() Fe(OH)3(s)+ 3 H+(aq) ΔH=(3b-a) kJ/mol;因为Ksp[Fe(OH)3]=2.79X10-39=c(Fe3+)·c(OH-)3,水解平衡常数Kh= c(H+)3/ c(Fe3+)=Kw3/ Ksp[Fe(OH)3]=10-3/2.79;
Fe(OH)3(s)+ 3 H+(aq) ΔH=(3b-a) kJ/mol;因为Ksp[Fe(OH)3]=2.79X10-39=c(Fe3+)·c(OH-)3,水解平衡常数Kh= c(H+)3/ c(Fe3+)=Kw3/ Ksp[Fe(OH)3]=10-3/2.79;
④因为氯化钴水解使溶液成酸性,所以加盐酸调整pH为2~3的目的为抑制CoC12的水解;
⑤从溶液中得到晶体需要蒸发浓缩、冷却结晶、过滤等,所以操作Ⅱ过程为蒸发浓缩、冷却结晶;
(7)电池放电时,正极发生还原反应,元素的化合价降低,根据所给化学方程式,Co元素的化合价降低,所以CoO2发生还原反应,生成LiCoO2,则放电时的正极反应为CoO2+Li++e-= LiCoO2。
考点:考查工业流程的分析,实验装置的判断、基本操作的判断,溶度积的应用,电化学反应原理的应用

 2H2O
2H2O  2CO2 CO2+Ca(OH)2=CaCO3↓+H2O
2CO2 CO2+Ca(OH)2=CaCO3↓+H2O  NH3?H2O
NH3?H2O NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
NH4++OH-;②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl  CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O  2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br
2CO2+2H2O ;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br  4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
4CO2+2H2O;②使KMnO4(H+)溶液褪色;③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2  的检验;
的检验;  的检验;
的检验;  苯酚的检验。
苯酚的检验。