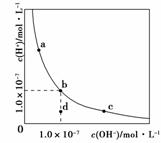
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
答案
C [A项,升高温度,促进水的电离平衡,则c(H+)和c(OH-)都同等程度地变大,若由c向b变化,则c(H+)增大,c(OH-)将变小,错误;B项,根据b点对应的c(H+)和c(OH-)都为1.0×10-7 mol/L,所以该温度下,水的离子积常数Kw=1.0×10-7×1.0×10-7=1.0×10-14,错误;C项,加入FeCl3发生水解反应:Fe3++3H2O![]() Fe(OH)3+3H+,破坏水的电离平衡,c(H+)增大、Kw不变,c(OH-)变小,则可能引起由b向a变化,正确;D项,c点对应的溶液呈碱性,稀释溶液,c(OH-)变小,Kw不变,c(H+)增大,故可引起由c向b的变化,而不是向d变化,错误。]
Fe(OH)3+3H+,破坏水的电离平衡,c(H+)增大、Kw不变,c(OH-)变小,则可能引起由b向a变化,正确;D项,c点对应的溶液呈碱性,稀释溶液,c(OH-)变小,Kw不变,c(H+)增大,故可引起由c向b的变化,而不是向d变化,错误。]

 NH4++NH2-,由于液氨的自偶电离程度比水要弱,所以是非电解质。
NH4++NH2-,由于液氨的自偶电离程度比水要弱,所以是非电解质。