利用氨水吸收烟气中的二氧化![]() 硫,其相关反应的主要热化学方程式如下:
硫,其相关反应的主要热化学方程式如下:
SO2(g)+NH3·H2O(a![]() q)===NH4HSO3(aq);ΔH1=a kJ·mol-1
q)===NH4HSO3(aq);ΔH1=a kJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)===(NH4)2SO3(aq)+H2O(l);ΔH2=b kJ·mol-1
2(NH4)2SO3(aq)+O2(g)===2(NH4)2SO4(aq);ΔH3=c kJ·mol-1
 (1) 反应2SO2(g)+4NH3·H2O
(1) 反应2SO2(g)+4NH3·H2O![]() (aq)+O2(g)===2(NH4)2SO4(aq)+2H2O(l)的ΔH=_______kJ·mol-1。
(aq)+O2(g)===2(NH4)2SO4(aq)+2H2O(l)的ΔH=_______kJ·mol-1。
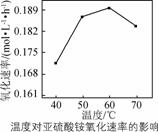
(2) 用空气氧![]() 化(N
化(N![]() H4)2SO3的速率随温度的
H4)2SO3的速率随温度的![]() 变化如右图所示,
变化如右图所示,
当温度超过60 ![]() ℃时,(NH4)2SO3氧化速率下降的原因可能是________。
℃时,(NH4)2SO3氧化速率下降的原因可能是________。
(3) 以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO(aq)SO(aq)+CaCO3(s),该反应的平衡常数K=________。
[已知Ksp( CaCO3) =2.9×10-9,Ksp( CaSO4) =9.1×10-6]
(4) ![]() (NH4)2SO4在工农业生产中有多种用途。
(NH4)2SO4在工农业生产中有多种用途。
① 将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为________。
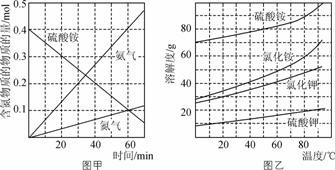
② 研究硫酸铵的分解机理有利于对磷石膏的开发。在500 ℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:___![]() _____。
_____。
③ (NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:________。
答案
(1) 2a+2b+c
(2) 温度过高(NH4)2SO3会分解,浓度减小(或温度升高氧气在溶液中溶解度降低![]() )
)
(3) 3 138
(4) ①2C![]() u2S+2(NH4)2SO4+5O24CuSO4+4NH3+2H2O
u2S+2(NH4)2SO4+5O24CuSO4+4NH3+2H2O
②3(NH4)2S6e-O4N2↑+4NH3↑+3SO2↑+6H2O↑
③配制较高温度(80℃-100℃)下的硫酸铵、氯化钾饱和混合溶液,冷却结晶,过滤、洗涤
(除第(4)题②、③每空3分外,其余每空2分,共14分)
