氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
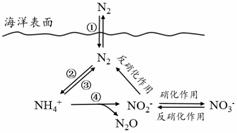
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是 (填字母序号)。
a. 海洋中存在游离态的氮
b. 海洋中的氮循环起始于氮的氧化
c. 海洋中的反硝化作用一定有氧气的参与
d. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时, 在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:
_____NH4+ + 5 O2 == 2 NO2- + _____H+ +__________+__________
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
| 温度/℃ | 样本氨氮含量/mg | 处理24 h | 处理48 h |
| 氨氮含量/mg | 氨氮含量/mg | ||
| 20 | 1008 | 838 | 788 |
| 25 | 1008 | 757 | 468 |
| 30 | 1008 | 798 | 600 |
| 40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是 ,在最佳反应温度时,48 h内去除氨氮反应的平均速率是 mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。右图是间接氧化工业废水中氨氮(NH4+)的示意图。
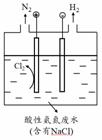
① 结合电极反应式简述间接氧化法去除氨氮的原理: 。
② 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将 (填“增大”、“不变”或“减小”),请简述理由: 。
答案
【答案】(共13分;除特殊标注外,每空2分)
(1)②;
(2) ad ;
(3)4NH4+ + 5O2 = 2NO2- + 6H+ + N2O + 5H2O;
(4)25℃;1.125;
(5)① Cl- -2e- = Cl2;产生的Cl2氧化废水中的NH4+释放出N2;
② 减小;电路中通过相同电量时,若生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多;
【解析】
试题分析:(1)氮的固定指将空气中游离态的氮转化为含氮化合物的过程,其中属于固氮作用的一步是②,故答案为:②;
(2)a、氮气在水中的溶解度较小,海洋中存在少量游离态的氮,正确;b、铵根离子中N的化合价为-3价,海洋中的氮循环起始于氮的还原,错误;c、反硝化作用中N的化合价降低,被还原,氧气是常见的氧化剂,具有氧化性,错误;d、向海洋排放含NO3-的废水,经过反硝化作用,会提高海水中的氮气的含量,再经过氮的固定转化为NH4+,从而提高NH4+的含量,正确;故选ad;
(3)反应中N的化合价由-3价升高到+5价,O的化合价由0价降低到-2价,根据化合价升降守恒和质量守恒,可知,还应该有水生成,配平得:4NH4+ + 5O2 = 2NO2- + 6H+ + N2O + 5H2O,故答案为:4NH4+ + 5O2 = 2NO2- + 6H+ + N2O + 5H2O;
(4)根据数据,硝化细菌去除氨氮的最佳反应温度是25℃,在最佳反应温度时,48 h内去除氨氮反应的平均速率=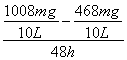 =1.125mg·L-1·h-1,故答案为:1.125;
=1.125mg·L-1·h-1,故答案为:1.125;
(5)① 在对含氮废水进行电解时,阳极氯离子放电,生成氯气,氯气具有强氧化性,将废水中的NH4+氧化生成氮气放出,起到降低废水中的氨氮含量的作用,故答案为:Cl- -2e- = Cl2;产生的Cl2氧化废水中的NH4+释放出N2;
② 阳极反应式为Cl- -2e- = Cl2,3Cl2+2NH4+=6Cl-+N2+8H+,阴极反应式为2H++2e-=H2,电路中通过相同电量时,若生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多,处理后废水的pH将减小,故答案为:减小;电路中通过相同电量时,若生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多。
考点:考查了工业废水处理的工艺流程、电解原理的应用、化学反应速率的计算的相关知识。

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L