氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
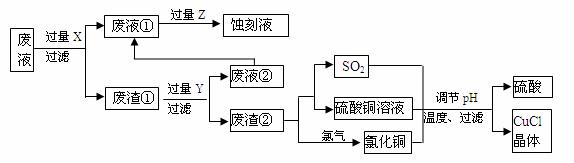
按要求回答下列问题:
(1)废液①的主要含有的金属阳离子是_____(填化学符号,下同);废渣①的主要含有的物质是________;Y为_______。
(2)检验Z过量的方法是______________________________。
(3)写出废渣②生成二氧化硫的化学方程式___________________________。
(4)为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
(5)生产过程中调节溶液的pH不能过大的原因是____________________________。
(6)写出产生CuCl的离子方程式___________________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g加入10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;
②待样品溶解后,加水50ml和2滴指示剂;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 =CuCl2 + FeCl2;Fe2+ + Ce4+ = Fe3+ + Ce3+。则CuCl的纯度为____________。
答案
【答案】(18分除标明分值外,其余每空均为2分) (1)Fe2+;Fe和Cu;HCl(每种物质1分)
(2)①取少量蚀刻液于试管中,②滴加少量品红溶液,③若品红褪色,证明Cl2过量,若不褪色,证明不足。(3分,每个要点1分,只写褪色结论不扣分)
(3)Cu+2 H2SO4(浓)![]() CuSO4+ SO2↑+2H2O(不写条件扣1分) (4)b
CuSO4+ SO2↑+2H2O(不写条件扣1分) (4)b
(5)防止生成氢氧化铜沉淀或防止CuCl水解
(6)SO2+2Cu2++2Cl-+2H2O====2CuCl↓+SO42-+4H+ (7)99%(3分)
【解析】
试题分析:(1)根据流程图可知废渣①中含有铜,这说明X应该是铁,将溶液中的铜离子置换出来。同时溶液中的铁离子也氧化铁,因此废液①的主要含有的金属阳离子是Fe2+ ;在反应中铁是过量的,则废渣①的主要含有的物质是Fe和Cu;Y能溶解废渣①中的铁,这说明Y应该是盐酸。
(2)废液①与Z反应得到刻蚀液,这说明Z应该是氯气,将溶液中的亚铁离子氧化为铁离子。如果氯气过量,则溶液中含有次氯酸,次氯酸具有强氧化性,可以用品红溶液检验,所以检验Z过量的方法是取少量蚀刻液于试管中,滴加少量品红溶液,若品红褪色,证明Cl2过量,若不褪色,证明不足。
(3)废渣②是铜,在加热的条件下与浓硫酸反应生成硫酸铜、SO2和H2O,反应的方程式为Cu+2 H2SO4(浓)![]() CuSO4+ SO2↑+2H2O。
CuSO4+ SO2↑+2H2O。
(4)氯化亚铜微溶于水、不溶于乙醇及稀硫酸,因此应该用乙醇洗涤,不能用水和氯化铜溶液洗涤。由于制备氯化亚铜的同时还有硫酸生成,因此也不能用稀硫酸洗涤,答案选b。
(5)pH过大,则碱性过强,容易生成氢氧化铜沉淀,同时也是为了防止氯化亚铜水解。
(6)氯化铜与SO2反应生成氯化亚铜、硫酸,反应的离子方程式为SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+。
(7)消耗硫酸铈的物质的量是0.10mol/L×0.025L=0.0025mol,则根据CuCl + FeCl3 =CuCl2 + FeCl2、Fe2+ + Ce4+ = Fe3+ + Ce3+可知
CuCl~ FeCl3 ~ FeCl2 ~ Ce4+
1mol 1mol
0.0025mol 0.0025mol
所以氯化亚铜的质量是0.0025mol×99g/mol=0.2475g
则CuCl的纯度为![]() ×100%=99%。
×100%=99%。
考点:考查物质制备工艺流程图的有关分析、判断与计算等

 。
。 C+MgO
C+MgO  MgO+H2O
MgO+H2O  2MgO
2MgO MgCl2
MgCl2  MgS
MgS Mg3N2
Mg3N2  Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq) Mg+Cl2↑
Mg+Cl2↑