锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造如图(a)所示。
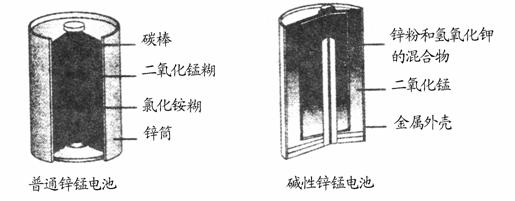
图(a)两种干电池的构造示意图
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是______________,电解质的主要成分是________,正极发生的主要反应是________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_____。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
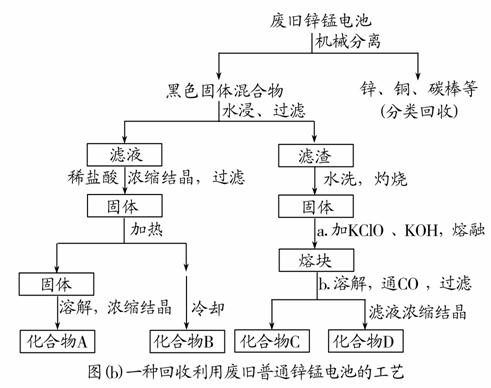
图(b)一种回收利用废旧普通锌锰电池的工艺
①图(b)中产物的化学式分别为A________,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______________________________。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是__________________________(填化学式)。
答案
[解析] (1)①失电子者为负极,负极材料为Zn,电解质为NH4Cl,正极发生的反应为:MnO2+NH![]() +e-===MnOOH+NH3↑。(2)①由普通锌锰电池反应产物和电池构造可知废旧电池经机械分离后得到的黑色固体混合物为ZnCl2、NH4Cl以及MnOOH等,该混合物经水浸后ZnCl2、NH4Cl进入溶液,利用NH4Cl受热易分解为NH3和HCl,NH3与HCl气体相遇又可化合生成NH4Cl,参照流程可推知A为ZnCl2、B为NH4Cl。②K2MnO4中Mn为+6价,在酸性条件下发生歧化反应生成KMnO4和MnO2,反应的离子方程式为:3MnO
+e-===MnOOH+NH3↑。(2)①由普通锌锰电池反应产物和电池构造可知废旧电池经机械分离后得到的黑色固体混合物为ZnCl2、NH4Cl以及MnOOH等,该混合物经水浸后ZnCl2、NH4Cl进入溶液,利用NH4Cl受热易分解为NH3和HCl,NH3与HCl气体相遇又可化合生成NH4Cl,参照流程可推知A为ZnCl2、B为NH4Cl。②K2MnO4中Mn为+6价,在酸性条件下发生歧化反应生成KMnO4和MnO2,反应的离子方程式为:3MnO![]() +2CO2===2MnO
+2CO2===2MnO![]() +MnO2↓+2CO
+MnO2↓+2CO![]() 。③电解K2MnO4溶液阳极得到KMnO4,阴极电极反应式:2H++2e-===H2↑。
。③电解K2MnO4溶液阳极得到KMnO4,阴极电极反应式:2H++2e-===H2↑。
[答案] (1)①Zn NH4Cl
MnO2+NH![]() +e-===MnOOH+NH3
+e-===MnOOH+NH3
②碱性电池不易发生电解质的泄漏,因为消耗的负极改装在电池的内部;碱性电池使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高(答案合理即可)
(2)①ZnCl2 NH4Cl
②3MnO![]() +2CO2===2MnO
+2CO2===2MnO![]() +MnO2↓+2CO
+MnO2↓+2CO![]()
③H2
